為了進一步推進特殊醫學用途配方食品注冊工作,國家食品藥品監督管理總局修訂了《特殊醫學用途配方食品穩定性研究要求(試行)(2017修訂版)》,于2017年9月5日發布并實施。此類研究的目的是通過設計試驗獲得產品質量特性在各種環境因素影響下隨時間變化的規律,并據此為產品配方設計、生產工藝、配制使用、包裝規格和包裝材料選擇、產品貯存條件和保質期的確定等提供支持性信息。
為方便企業更直觀的了解及應用《特殊醫學用途配方食品穩定性研究要求(試行)(2017修訂版)》,杭州瑞旭集團對其中的具體試驗要求以及對提交材料的要求進行了歸納總結,具體內容如下所示:
1. 特醫食品穩定性研究試驗
穩定性研究應根據不同研究目的,結合食品本身的特性進行合理設置。其中,影響因素試驗、加速試驗和長期試驗為必做試驗;依據產品自身特點,可選擇其他試驗,例如開啟后使用的穩定性試驗等。
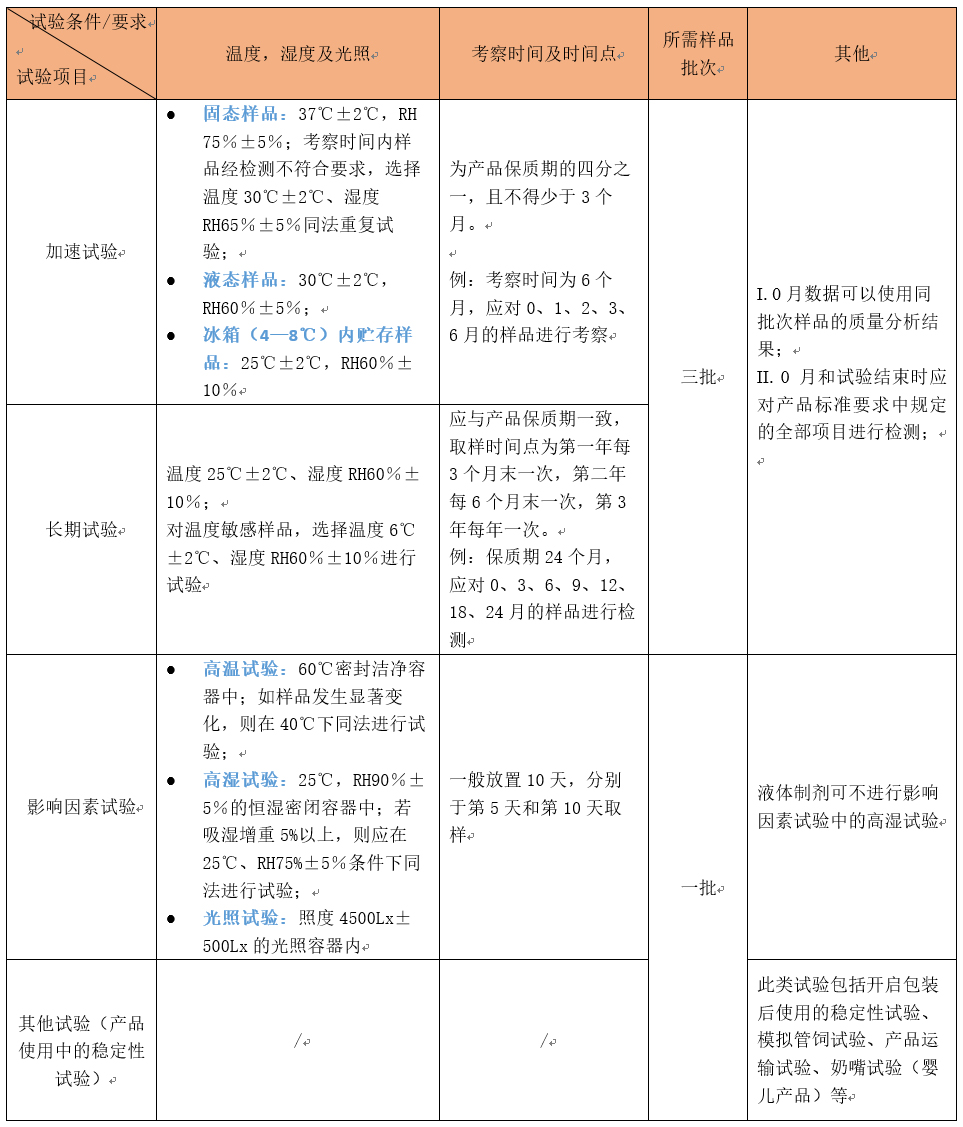
注:長期穩定性試驗與加速試驗應同時開始,申請人可在加速試驗結束后提出注冊申請,并承諾按規定繼續完成長期穩定性試驗。
2. 材料要求
產品注冊申請時,申請人應當提交以下與穩定性研究有關的材料:
- 1) 試驗樣品的名稱、規格、批次和批產量、生產日期和試驗開始時間;
- 2) 不同種類穩定性試驗條件,如溫度、光照強度、相對濕度等;
- 3) 包裝材料名稱和質量要求;
- 4) 穩定性研究考察項目、分析方法和限度;
- 5) 以表格的形式提交研究獲得的全部分析數據;
- 6) 各考察點檢測結果,應以具體數值表示,其中營養成分檢測結果應標示其與首次檢測結果的百分比。計量單位符合我國法定計量單位的規定,不宜采用“符合要求”等表述。在某個考察點進行多次檢測的,應提供所有的檢測結果及其相對標準偏差(RSD);
- 7) 產品在貯存期內存在的主要風險、產生風險的主要原因和表現,產品穩定性試驗種類選擇依據,不同種類穩定性試驗條件設置、考察項目和考察頻率確定依據,穩定性考察結果與產品貯存條件、保質期、包裝材料及產品食用方法確定之間的關系,對試驗結果進行分析并得出試驗結論。
注:穩定性試驗報告與穩定性研究材料在產品注冊申請時一并提交(對于特殊醫學用途嬰兒配方食品和全營養配方食品,申請人可保留記錄備查,無需提交)。
更多關于特醫食品注冊的信息,請點擊特殊醫學用途配方食品注冊
