我國是世界上較早制定新食品原料(舊稱新資源食品)管理制度的國家。1983年的《食品衛生法》(試行)中首次提出了利用新資源生產的食品必須經衛生部門審批,原衛生部于1987年發布首個配套法規。經過30多年的發展,眾多新食品原料獲得批準,并廣泛應用于各類食品中。
1. 新食品原料的發展歷程
從1987年至今,新食品原料的審批歷經了四部法規的變遷,管理方式發生了很大的變化,法規監管體系日益完善。
表1 新食品原料的政策發展歷程
|
時間段 |
法規 |
歷史名 稱 |
管 理對象 |
主要管理方式及變化 |
|
1987-1990 |
《食品新資源衛生管理辦法》 |
新資源食品 |
終產品或食品原料 |
由于年代久遠,該階段的管理辦法原文已無官方公告可尋。 |
|
1990.07.27-2007.11.30 |
《新資源食品衛生管理辦法》 |
新資源食品 |
終產品或食品原料 |
I. 該階段的產品在獲準正式生產前必須經過兩年試生產階段,而后方能申請正式生產批件; II. 審批通過后向該產品的申報企業核發批準證書; |
|
2007.12.01-2013.09.30 |
《新資源食品管理辦法》 |
新資源食品 |
食品原料 |
I. 取消了試生產制度; II. 管理對象變為“食品原料”; III. 由“單個終端產品發證”轉變為“以名單形式向社會公告”, 避免了同類產品的重復審批; IV. 提出了“實質等同”審查制度。 |
|
2013.10.01-至今 |
《新食品原料安全性審查管理辦法》 |
新食品原料 |
食品原料 |
I. “新資源食品”正式被“新食品原料”取代,并重新定義了新食品原料的范圍; II. 申報資料中增加了由風險評估單位出具安全性評估意見的要求; III. 增加了向社會征求意見的審核程序。 |
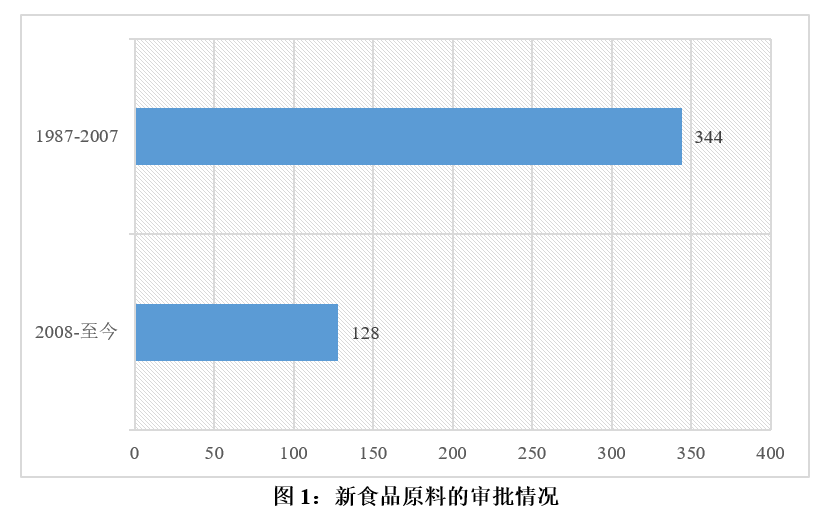
據統計,1987-2007年的20年間,原衛生部共計批準了344個新資源食品,其中大量產品以終產品形式獲得批準,例如天府可樂、少林可樂、中國花粉口服液等。而經過2年的試生產后申請轉為正式生產的產品僅有76個,占全部批準總數的22%。
2007年12月1日起,我國新食品原料的管理理念發生變化,審批對象轉為食品原料。2008年至今,共計128個新食品原料獲得批準,其中原料新品種和微生物新品種分別為105個和23個。您可通過獲取瑞旭集團發布的《新食品原料中國市場準入指南》查看詳細的批準名單。
2. 新食品原料的應用
新食品原料源于食品工業日新月異的發展。將新食品原料應用于食品生產中,亦是企業自我創新,開拓新市場的手段之一。自我國新食品原料以食品原料為審評對象批準以來,一系列獲得批準的新食品原料得以在各類食品中發光發熱。
2.1 在普通食品中的應用
新食品原料在普通食品中的應用十分廣泛,魚油凝膠糖果、瑪咖固體飲料、藍莓葉黃素酯壓片糖果、蘆薈含乳飲料(庫拉索蘆薈凝膠)等各類產品中均涌現出了新食品原料的身影。預包裝普通食品企業在使用某種新食品原料時,應嚴格按照批準公告執行,尤其需注意以下三方面:
- 使用范圍
- 食用量
- 標簽、說明書要求
表2 新食品原料應用于普通食品中的注意事項
|
舉例 |
公告相關內容 |
注意事項 |
|
乳木果油 |
使用范圍:巧克力、糖果、冰激淋、烘焙產品及煎炸油,但不包括嬰幼兒食品。 |
僅公告所列的幾個產品類別可使用乳木果油,其他食品類別(如飲料)等均不可添加乳木果油。 |
|
瑪咖粉 |
1)食用量≤25克/天; 2)嬰幼兒、哺乳期婦女、孕婦不宜食用;食品的標簽、說明書中應當標注不適宜人群和食用限量。 |
I. 根據產品的凈含量、食用方法等情況適當添加瑪咖粉; II. 應在產品標簽上標識如下信息: 本品含xx克瑪咖粉。瑪咖粉食用量應≤25克/天,且嬰幼兒、哺乳期婦女、孕婦不宜食用。 |
2.2 在保健食品中的應用
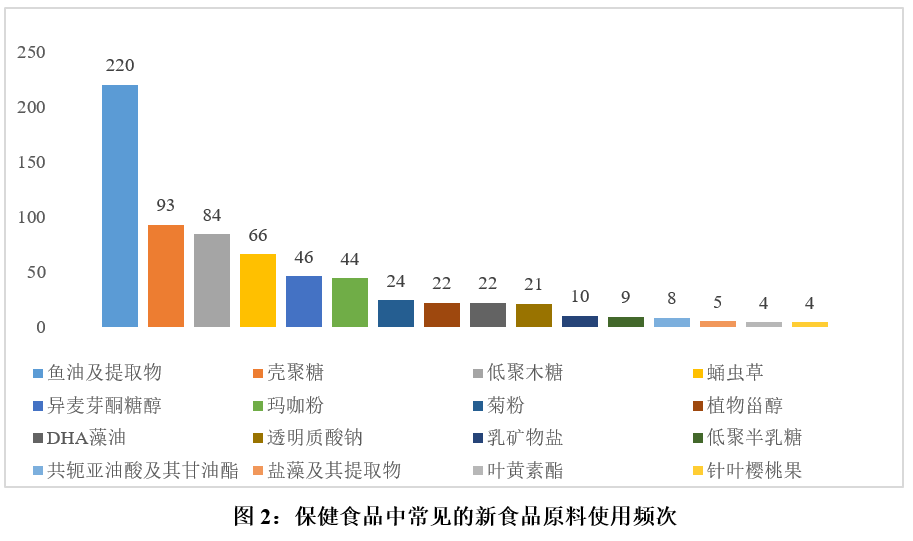
已批準的新食品原料可作為保健食品的原料來源之一。據瑞旭集團的統計,已注冊保健食品中常見的新食品原料使用情況如圖2所示(實際上,魚油、殼聚糖這些應用頻次較高的原料,在被批準為新食品原料前,在保健食品中已有一定的使用歷史)。從這些應用中也可以看出,脂類原料和碳水化合物類原料是在保健食品中最受歡迎的兩大新食品原料。
除此之外,酵母β-葡聚糖、珠肽粉、γ-氨基丁酸、杜仲籽油、短梗五加等已批準的新食品原料也均在保健食品中有少量應用。
值得一提的是:在保健食品中使用新食品原料時,保健食品企業通常會向獲得國家衛建委(原衛計委、原衛生部)新食品原料批準的廠家購買原料,并索取相關的批準文件,以避免在保健食品注冊申報過程中,證明所使用的原料與批準的原料具有實質等同性的過程。
2.3 在特殊醫學用途配方食品中的應用
特殊醫學用途配方食品(FSMP)中添加新食品原料,應當按照批準公告的要求執行,同時滿足FSMP的食品安全國家標準及相關規定。
例:某COPD病人用全營養配方食品中添加魚油及提取物,需注意:
I. 魚油及提取物的成分和質量要求等符合原衛生部2009年第18號公告的規定;
II. 產品中魚油及提取物的含量需按照GB29922問答中,對于n-3脂肪酸(以EPA和DHA)的含量規定進行適當調整。
目前,FMSP中新食品原料的應用并不廣泛。FSMP注重產品對進食受限或特定疾病狀態下人群的營養補充與支持作用,而許多新食品原料,由于其對營養補充、支持所起到的作用非常有限或是含有FSMP中不允許添加的其他生物活性成分,因而并不適用于FSMP。企業在選用某種新食品原料時,應當首先考慮此物質加入配方后起了哪些方面的營養支持、補充的作用。
(PS. 更多關于FSMP中原料的使用,您可點擊特殊醫學用途配方食品原料淺析進行查看)
3. 未來,哪些新食品原料在路上
目前,根據國家食品安全風險評估中心的相關公告,趕黃草、 β-1,3-葡聚糖、瑞士乳桿菌R0052、嬰兒雙歧桿菌R0033、兩歧雙歧桿菌R0071……等申報的新食品原料都已對外公開征求意見。若它們都能順利通過最終審批,食品企業們將獲得更廣闊的原料選擇空間,讓我們共同期待!
我們的服務:
