醫療器械臨床試驗是基于“醫療器械臨床試驗質量管理規范”(行業也稱醫療器械GCP)及相關法規開展的以驗證醫療器械產品的安全性和有效性的研究活動。醫療器械臨床試驗主要包括臨床試驗準備階段、臨床試驗實施階段和臨床試驗結題階段三個階段,本文從醫療器械臨床試驗流程中各節點主要工作進行了解析。
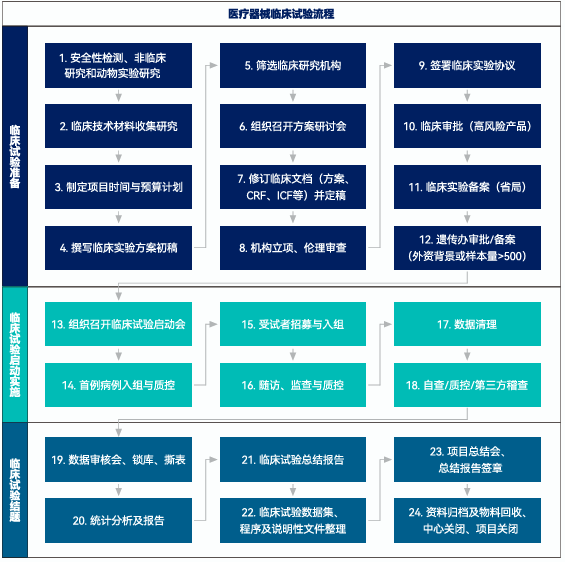
階段一、臨床試驗準備
1. 醫療器械臨床前安全性驗證
醫療器械臨床試驗前需先通過安全性驗證,包括產品檢測、動物實驗及其它非臨床研究。
2. 臨床技術資料收集研究
3. 制定項目時間和預算計劃
4. 撰寫臨床試驗方案初稿
5. 臨床試驗機構篩選
醫療器械臨床試驗應在已備案的醫療器械臨床試驗機構中開展。
6. 組織召開方案研討會
7. 修訂臨床文檔(方案、CRF、ICF、IB等)并定稿
8. 立項和倫理審查
9. 與臨床試驗機構簽署臨床研究協議
10. 涉及高風險醫療器械,臨床試驗前應申請臨床試驗審批
11. 省局備案臨床試驗
12. 涉及外資背景的申辦方或CRO或樣本量大于500的還應申請人類遺傳資源備案或審批
階段二:臨床試驗啟動實施
13. 組織召開臨床試驗啟動會
14. 首例入組并完成質控
15. 受試者招募與入組
16. 隨訪、監查與質控
17. 入組結束,數據清理
18. 數據自查、質控或第三方稽查
階段三:臨床試驗結題歸檔
19. 數據審核、鎖庫,必要時召開數據審核會
20. 統計分析及報告
21. 臨床試驗小結及總結報告
22. 臨床試驗遞交數據整理,包括原始數據集、分析數據集、程序代碼和說明性文件等
23. 項目總結會,報告簽章
24. 資料歸檔及物料回收,項目關閉及中心關閉
