醫療器械主文檔是一種技術資料形式,該類資料由其所有者提交給醫療器械技術審評機構,用于授權醫療器械注冊申請人在申報醫療器械注冊等事項時引用其作為注冊申報資料的一部分。醫療器械主文檔制度可以方便醫療器械生產企業選擇原材料和關鍵元器件,簡化注冊申報。同時,主文檔資料登記的自愿原則和保密原則,可以很好的保護主文檔所有者的知識產權。
PEEK聚醚醚酮是一種具有耐高溫、自潤滑、易加工和高機械強度等優異性能的高分子聚合物,由于PEEK可耐反復的滅菌,在醫療器械中可用于制造內窺鏡零件、牙科用的去垢器等。另外,由于PEEK的高強度和低溶出性,還可用于儀器分析的液相色譜柱、管、附件等。而且由于PEEK與人體具有很好的相融性,可作為人工骨材料修復骨缺損以及作為一些植入器械的原材料。
醫療器械原材料(體外診斷試劑除外)的技術資料一般是指原材料組成成分描述、理化性能研究資料、生物學評價資料、毒理學風險分析資料,工藝研究等。PEEK可參考以下指標進行試驗。
(1)理化性能
包括拉伸強度(屈服)、拉伸強度(斷裂)、斷裂伸長率、彎曲強度、彎曲模量、懸臂梁缺口沖擊強度、密度、黏度、玻璃化轉變溫度、熔融峰溫、負荷變形溫度,重金屬含量等,具體可參考YY/T 0660 外科植入物用聚醚醚酮(PEEK)聚合物的標準規范和GB/T 41873-2022塑料 聚醚醚酮(PEEK)樹脂。
(2)鑒別
PEEK主要通過紅外光譜進行鑒別,主要吸收峰與標準對照圖譜的特征吸收峰要一致。典型譜圖如下:
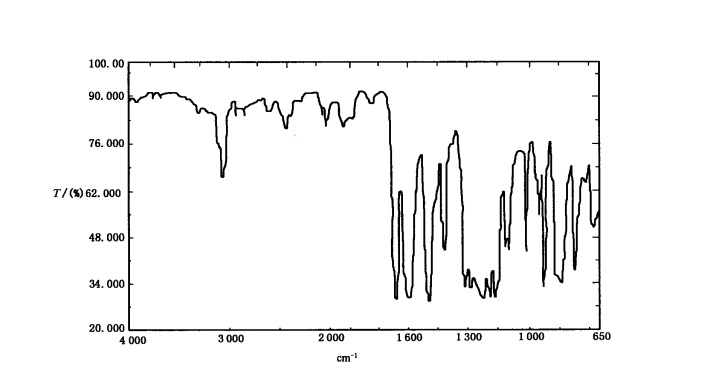
(3)生物相容性
作為醫療器械的原材料,可根據終端產品按照GB/T 16886.1的要求進行相應的生物學試驗。例如作為外科植入物,在使用過程中與人體皮膚接觸,肌肉,骨組織等接觸,接觸時間為持久(大于30d)。則考慮細胞毒性、致敏反應、刺激或皮內反應、材料介導的致熱性、急性全身毒性、亞急性毒性、亞慢性毒性,慢性毒性,植入反應,遺傳毒性和致癌性試驗項目。
(4)滅菌驗證
PEEK可耐反復的滅菌,用PEEK制造的醫療器械及醫療器械部件可被滅菌。可使用的滅菌方法包括蒸汽、環氧乙烷以及射線滅菌。但重復滅菌可能會削弱材料本身的強度和理化性能,因此生產企業需要對進行不同滅菌方式以及滅菌次數的研究,以驗證PEEK在規定的滅菌方式和滅菌次數后性能,結構組成,生物學等方面依舊符合要求。
(5)貨架有效期和包裝運輸
登記產品可考慮按照醫療器械對原材料的要求進行有效期和包裝運輸驗證,可參考《無源植入性醫療器械貨架有效期注冊申報資料指導原則》、GBT 19633系列、YYT 0681系列等依據進行相關試驗。
截止到2024年11月19日,國家局已成功登記的PEEK原材料產品有9款,匯總如下:
序號 | 所有者名稱 | 主文檔登記事項名稱 | 主文檔登記號 | 登記/更新時間 |
27 | 武漢北慕科技有限公司 | 聚醚醚酮(PEEK)注塑工藝主文檔 | M2021027-001 | 2023-01-04 |
73 | 麟科泰醫療技術(無錫)有限公司 | 等離子噴涂純鈦涂層"Spondycoat® - T 107"在PEEK基材上的醫學應用主文檔 | M2022041-002 | 2024-03-15 |
82 | 麟科泰醫療技術(無錫)有限公司 | 等離子噴涂純鈦涂層"Spondycoat® - T 371A"在PEEK基材上的醫學應用 | M2022050-001 | 2023-04-21 |
140 | 廣州聚生醫療科技有限公司 | 外科植入物用聚醚醚酮(PEEK)原材料主文檔 | M2022108-000 | 2022-11-28 |
313 | 常州君華醫療科技有限公司 | AKSOPEEK醫用植入級PEEK純料主文檔 | M2023173-002 | 2024-04-11 |
324 | 英國Invibio有限公司 | PEEK-OPTIMA® 碳纖維增強型聚醚醚酮復合材料 | M2023184-000 | 2023-12-26 |
432 | 常州君華醫療科技有限公司 | 短切碳纖維植入級PEEK材料主文檔 | M2024102-001 | 2024-08-10 |
453 | 英國Invibio有限公司 | PEEK-OPTIMA® 長鏈碳纖維超級增強型聚醚醚酮復合材料 | M2024123-000 | 2024-05-11 |
486 | 吉林省中研高分子材料股份有限公司 | PEEK-LISCIEX 聚醚醚酮原材料主文檔 | M2024156-000 | 2024-06-08 |
更多主文檔登記信息可在【國家藥品監督管理局醫療器械技術審評中心-信息公開-主文檔登記信息公示】欄查看。
