歐洲
5月10日,烏克蘭環境保護與自然資源部宣布,政府已正式批準了化學品分類、標簽和包裝(CLP)的規定,并于2024年6月29日正式生效。
這一新規定采納了聯合國的全球化學品統一分類和標簽制度(GHS)的第九修訂版,旨在順應全球范圍內統一化學物質和混合物的分類和標記規則。烏克蘭CLP法規主要規定包括:建立包含危害分類、標簽元素等的國家化學品清單,危險化學品(含危害分類、警示詞、標簽元素等)則需登記在冊。危險化學品的危害分類標準與GHS第九修訂版一致。為了對化學品的危險性進行分類,制造商、進口商、供應商和其他市場經營者需要從可靠的來源收集關于化學品危險特性的所有可用信息,評估其有效性,并依此進行全面的危險分類。對于被分類為危險的化學品,經營者在將其投放市場前必須確保這些化學品采用適當的包裝,并附上相應的危險信息標簽。
5月17日,歐盟修訂化妝品中十甲基環戊硅氧烷和十二甲基環己硅氧烷使用要求。
據歐盟官方公報消息,歐盟委員會發布實施條例 (EU)2024/1328,修訂(EC)1907/2006法規。主要內容為:授權十甲基環戊硅氧烷 (D5) 和十二甲基環己硅氧烷 (D6) 使用規定,自2026 年 6 月 6 日后允許在化妝品中十甲基環戊硅氧烷 (D5) 和十二甲基環己硅氧烷 (D6)最高濃度為 0.1%,該條例應在歐盟官方公報上公布后20天生效。
5月23日,歐盟SCCS新發布關于二氧化鈦的科學建議:遺傳毒性不能排除。
歐盟消費者安全科學委員會(SCCS)發布關于二氧化鈦(INCI名稱:Titanium dioxide,CAS/EC No. 13463-67-7/236-675-5, 1317-70-0/215-280-1, 1317-80-2/215-282-2)的最終意見(SCCS/1661/23)。對于二氧化鈦在口腔化妝品中的使用,現有證據不足以排除所有二氧化鈦等級的潛在遺傳毒性。不過,兩種納米級二氧化鈦(RM09和RM11)的數據表明它們沒有遺傳毒性問題。但還需要更多關于納米級二氧化鈦在口腔黏膜中的潛在攝取和細胞效應的信息,以考慮它們在口腔護理產品中的使用安全。值得強調的是,口腔化妝品含有二氧化鈦成分的量遠遠低于作為食品添加劑攝入的量,因此納米顆粒在口腔粘膜中潛在吸收/保留、遷移和有害效應是安全性評估的重要考慮因素。
5月27日,歐盟SCCS發布新涂層納米二氧化鈦(Eclipse 70)的安全評估意見。
歐盟消費者安全科學委員會(SCCS)發布對具有新涂層的二氧化鈦(納米)(new coating for Titanium Dioxide (nano form),Eclipse 70)的安全評估結果(SCCS/1667/24)。SCCS表示,由于現有的信息并不能證明Eclipse 70在理化性質、涂層穩定性和皮膚吸收等方面與之前評估過的二氧化鈦(納米)原料(SCCS/1516/13 - Revision of 22 April 2014)的相似性,因此無法對Eclipse 70作為紫外吸收劑的安全性得出最終結論。Eclipse 70的涂層由6%氫氧化鋁、14%肉豆蔻酰肌氨酸鈉和10%二甲基硅氧烷構成。
6月24日,歐盟化妝品法規將禁用20余種CMR(致癌、致突變或生殖毒性)物質,法規預計于2025年第3季度通過并實施。
歐盟委員會向世界貿易組織(WTO)遞交G/TBT/N/EU/1070號通報,擬對(EC) No 1223/2009(即歐盟化妝品法規)附錄Ⅱ(禁用)和附錄Ⅲ(限用)進行修訂。主要新增了 (EC) No 1272/2008(即歐盟CLP法規)附錄Ⅵ在2023年10月修訂時明確的致癌、致突變或生殖毒性(CMR)物質。
北美
5月3日,美國發布《有毒物質控制法》下的化學品風險評估程序,本最終規則于2024年7月2日生效。
美國環境保護局(EPA)根據《有毒物質控制法》(TSCA)進行風險評估的程序框架規則進行最終修訂。根據《有毒物質控制法》進行風險評估的目的是,在不考慮成本或非風險因素的情況下,確定某種化學物質是否對健康或環境構成不合理的傷害風險,包括在使用條件下對環保局確定的與風險評估相關的潛在暴露或易感人群構成不合理的風險。EPA 重新考慮了進行此類風險評估的程序框架規則,并正在修訂該框架的某些方面,以更好地與法規文本和適用的法院判決保持一致,反映該局在 2016 年 TSCA 修正案頒布后實施風險評估計劃的經驗,并允許在風險評估過程中考慮未來的科學進步,而無需進一步修訂該局的程序規則。
5月14日,美國擬修訂出口食品和化妝品官方證書申請要求。該公告將在2024年5月15日的聯邦公報上正式發布,意見反饋期為60天。
據美國聯邦公報消息,美國食藥局(FDA)發布2024-10606號公告,擬修訂出口食品和化妝品官方證書申請要求。修訂的主要內容為:(1)取消原先出口商申請食品和化妝品證書(如自由銷售證明)時需要填寫紙質表格的要求,改為通過在出口證書申請和追溯系統(eCATS)填寫電子表格的方式進行網上申請,健康證書則通過電子郵件申請;(2)進一步優化證書申請系統的信息上傳和查詢功能等。
5月17日,加拿大衛生部發布了最新的化妝品成分熱門名單。
由于可能的發育后果,將堿性綠4(也稱為孔雀石綠)添加到禁用物質名單中。此外,在更新中,以下3種成分被添加到限制物質清單中:二苯甲酮,最高濃度可達3%;對氯間甲苯酚,禁止用于粘膜上或粘膜附近的產品,如口腔、鼻子或眼睛的粘膜;其他化妝品中最高濃度可達0.1%。溶劑紫13,在除指甲產品以外的化妝品中的最高濃度可達0.3%。
化妝品成分熱門名單:在加拿大銷售化妝品必須遵守《食品藥品法》(FDA)和《化妝品條例》(CR)。根據美國食品藥品監督管理局第16條,在加拿大生產、進口或銷售的化妝品必須安全使用。加拿大衛生部通過行政機制“化妝品成分熱門名單”通知生產商和其他利益相關者可能禁止或限制化妝品中使用的某些成分。目前,數百種化妝品成分被列入熱名單,其中包括兩部分,一部分用于禁用成分,另一部分用于限制成分。
5月30日,美國佛蒙特州限制特定產品中PFAS和其他化學物質的使用,該法案將于2024年7月1日生效,并分階段實施。
美國佛蒙特州州長簽署法律SB 25,限制某些特定產品中全氟和多氟烷基物質(PFAS)、雙酚物質和鄰苯二甲酸酯等物質的使用。

6月11日,加拿大就登記含有丁氟螨酯成分的殺螨劑征求意見。此次登記的公眾評論期為2024年6月11日至2024年7月26日。
加拿大衛生部發布PRD2024-07號咨詢文件,有害生物管理局(PMRA)擬批準登記含有丁氟螨酯(cyflumetofen)成分的殺螨劑。此次意見征集的主要內容是將含丁氟螨酯的殺螨劑用于控制溫室作物上的各種螨蟲,特別是草莓、番茄、辣椒和黃瓜。
亞太地區
5月6日,國家藥監局發布關于成立化妝品標準化技術委員會的公告(2024年第53號)
委員會由164名委員組成,秘書處設在中國食品藥品檢定研究院。委員會設職務委員,由國家藥監局和中國食品藥品檢定研究院相關負責人組成。委員會下設8個分技術委員會,通用技術要求、原料和包裝材料、安全評價等3個分技術委員會秘書處設在中國食品藥品檢定研究院,人體安全與功效評價分技術委員會秘書處設在北京大學第一醫院,產品分技術委員會秘書處設在山東省食品藥品檢驗研究院和中國香料香精化妝品工業協會,檢驗檢測分技術委員會秘書處設在廣東省藥品檢驗所,牙膏通用要求分技術委員會秘書處設在北京大學口腔醫院,牙膏檢驗檢測分技術委員會秘書處設在江蘇省產品質量監督檢驗研究院。
5月10日,國家藥監局發布《化妝品中雙氟拉松丙酸酯的測定》化妝品補充檢驗方法的公告(2024年第57號)
本方法規定了化妝品中雙氟拉松丙酸酯的測定方法。本方法適用于液體(水、油)類、膏霜乳類、凝膠類、蠟基類化妝品中雙氟拉松-17-丙酸酯和雙氟拉松-21-丙酸酯的定性和定量測定。
5月15日,中檢院關于公開征求《化妝品中非那西丁的檢驗方法(征求意見稿)》等意見的通知
為進一步完善化妝品技術標準,中檢院組織制定了《化妝品中非那西丁的檢驗方法(征求意見稿)》、《化妝品中葡糖醛酸等14種原料的檢驗方法(征求意見稿)》、《化妝品中葡糖酸等3種原料的檢驗方法(征求意見稿)》、《化妝品中羥基癸酸的檢驗方法(征求意見稿)》、《化妝品中石棉的檢驗方法(征求意見稿)》、《牙膏中可溶氟、游離氟的檢驗方法(征求意見稿)》、《體外皮膚變態反應ARE-Nrf2熒光素酶LuSens試驗方法(征求意見稿)》,共7項檢驗方法,現公開征求意見。
5月17日,印尼取消對化妝品的進口許可證(PI)要求,產品清關將更便捷。
2024年3月10日,2023年36號貿易部長令生效,對進入印尼的多種商品提出了“進口許可證 (PI) ”和“進口配額”的要求,所涉及的商品類型有電子產品、化妝品、服裝等。新的法規要求大大增加了清關時間,直接導致數萬個集裝箱積壓在印尼各大港口,嚴重影響了港口正常貿易。因此,為了緩解港口貨物積壓,印尼政府決定降低進口許可的門檻,針對Permendag 36/2023修訂的Permendag 8/2024就此出臺,重新放寬了部分種類產品的進口限制,其中就包括化妝品。
5月31日,中檢院關于公開征求《化妝品新原料安全使用歷史研究和判定指南(試行)(征求意見稿)》、《化妝品新原料安全食用歷史研究和判定指南(試行)(征求意見稿)》的通知
《化妝品新原料安全使用歷史研究和判定指南(試行)(征求意見稿)》遵循依法依規原則,貫徹落實《條例》及配套法規文件中關于化妝品新原料的法規要求,研究新原料滿足在上市化妝品中已有3年以上安全使用歷史的證明資料的具體要求,切實為新原料的注冊申報和備案資料提交提供技術指導,也為技術審評以及監管提供依據。
6月7日,澳大利亞聯邦公報發布F2024L00657號公告,批準修訂2024年治療用品(防曬霜)修正案,該公告自2024年7月1日起生效。
主要內容:(1)制訂澳大利亞/新西蘭標準AS/NZS2604:2021《防曬產品-評估和分類》標準;(2)有防曬霜的唇部和的有色底霜和粉底產品必須不含禁用的藥物,要在標簽注明防護因素并符合廣譜產品的性能要求;(3)有防曬霜的用于皮膚的保濕護膚產品(包括抗皺、抗衰老和美白產品)必須不含禁用的藥物;要在標簽注明防護因素;宣稱防曬系數不得超過UVAPF15,保存期限超過36個月的應標明保質期;包裝容量不超過300ml或300g;除宣稱可抗與日曬有關的過早衰老外,不得宣稱其它治療效果(包括與皮膚癌有關的聲明);(4)含有防曬成分的日光浴護膚產品(如油、霜、凝膠、不含防曬成分的美黑產品和曬后護理產品)防曬系數至少UVAPF4不超過UVAPF15;要在標簽注明防護因素并符合廣譜產品的性能要求;宣稱防曬系數不得超過UVAPF15,保存期限超過36個月的應標明保質期;包裝容量不超過300ml或300g;除宣稱可抗與日曬有關的過早衰老外,不得宣稱其它治療效果(包括與皮膚癌有關的聲明)。
6月14日,韓國發布《衛生用品標準和規范的臨時認可條例》,該條例評議期截止至2024年8月13日。
韓國發布《衛生用品標準和規范的臨時認可條例》。該條例主要內容如下:A、規定了以前未被承認為衛生用品的物品;B、規定了識別衛生用品的程序;C、規定了申請人需填寫和提交的表格;D、規定了如何編寫附錄1中提交的文件。
6月18日,國家藥監局綜合司印發《藥品監管人工智能典型應用場景清單》(以下簡稱《清單》)。
《清單》列出了15個具有引領示范性的、有發展潛力的、針對工作痛點的、需求較為迫切的應用場景。在形式審查場景中,對化妝品法規要求的各類申報材料進行自動化審查。在輔助審評場景中,一是應用于產品配方的深入分析,通過信息比對輔助識別潛在的原料風險物質,并支持合規性評估;二是基于產品標簽的識別分析,涉及標簽規范性驗證、成分信息的精準匹配、禁用詞匯在銷售包裝宣稱中的自動檢索及預警、檢測并提示銷售包裝宣稱是否超越規定的功效宣稱范圍等方面,從而強化審評工作的全面性和嚴謹性。
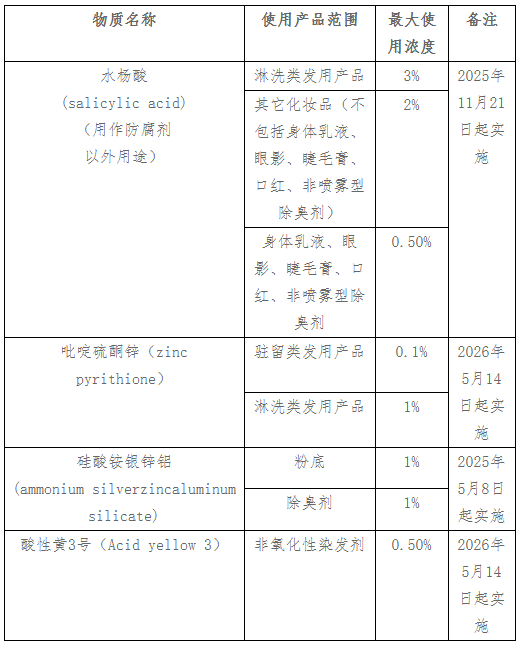
6月19日,馬來西亞國家藥品管理局發布2/2024號公告,修訂《化妝品管制法規》。該公告自發布之日起生效。
主要內容為:化妝品限制使用的成分清單中新增水楊酸等4種物質,并規定使用要求。具體如下表。
6月26日,中國臺灣特定用途化妝品登記制度有變,自2024年7月1日生效。
中國臺灣衛生福利部食品藥物管理署(TFDA,以下簡稱“中國臺灣食藥署”)發布《應完成產品登錄之化妝品種類》,規定,除免辦理工廠登記的化妝品制造場所生產的固態手工香皂外的化妝品,都需要進行產品登錄。此文件的發布,意味著特定用途化妝品查驗登記制度的廢除。事實上,特定用途化妝品查驗登記制度已在中國臺灣實施近5年,且該制度的取消早已被列入計劃(在特定用途化妝品查驗登記制度實施前,中國臺灣對“含藥化妝品”實施許可登記制度)。隨著該制度的廢止,特定用途化妝品無需查驗登記,僅需完成產品登錄程序,即可進行生產或進入臺灣地區。同時,隨著該制度的取消,化妝品不再區分特定用途和一般用途,而是用單一類別進行管理。
6月27日,由中國檢驗檢測學會立項、中國標準化研究院等單位參與研究制定的《化妝品中β-煙酰胺單核苷酸(NMN)含量測定高效液相色譜法》團體標準正式發布。
該標準主要涵蓋了實驗方法、儀器要求、數據處理等方面的內容。國家藥監局化妝品新原料備案信息平臺顯示,多家企業備案了NMN,目前NMN已有10個化妝品新原料備案號。
