截至2023年6月30日,歐洲食品安全局(EFSA)2023年的第二季度批準的新原料數量較第一季度(2023Q1歐盟Novel Food匯總-EFSA批準3個HMO,2個昆蟲等10個新原料)顯著減少,共計批準4個新原料,其中包括1個HMO——6’SL。瑞旭就具體產品信息整理如下:
表1:獲批新原料
|
序號 |
日期 |
名稱 |
英文名 |
|
1 |
2023.5.12 |
Cellobiose |
|
|
2 |
2023.5.15 |
6’-Sialyllactose sodium salt |
|
|
3 |
Ir on milk caseinate | ||
|
4 |
2023.5.17 |
Aqueous ethanolic extract of Labisia pumila |
1. 纖維二糖 (Cellobiose)
2023年5月12日,歐盟委員會發布新條例(EU) 2023/943,根據歐洲議會和理事會法規(EC) No 2015/2283,批準纖維二糖作為新食品投放市場。本法規自2023年6月1日起正式生效。
申報公司: SAVANNA Ingredients GmbH(德國)
自2023年6月1日起的五年內,僅SAVANNA Ingredients GmbH有權在歐盟市場銷售纖維二糖,除非:
1. 后續申請人的申報材料符合(EU)2015/2283第26條規定,未參考SAVANNA Ingredients GmbH納入數據保護的專有科學依據或數據;
2. 后續申請人獲得SAVANNA Ingredients GmbH的授權。
批準使用范圍和用量見下:
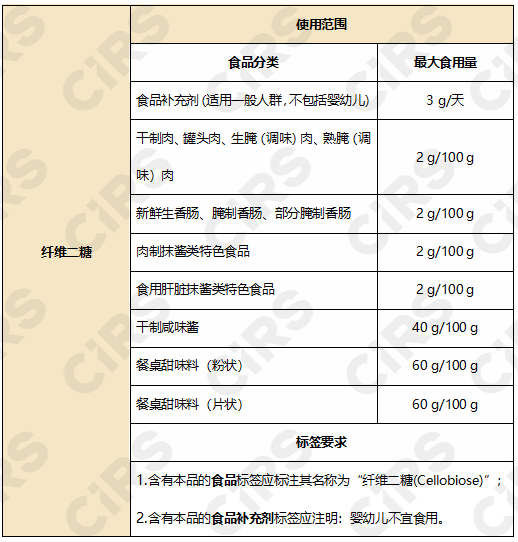
2. 6’-唾液酸乳糖鈉鹽(微生物來源)6’-Sialyllactose sodium salt produced by derivative strains of E. coli BL21(DE3)
2023年5月15日,歐盟委員會發布新條例(EU) 2023/948,根據歐洲議會和理事會法規(EC) No 2015/2283,批準6’-唾液酸乳糖鈉鹽(來源:大腸桿菌BL21 (DE3)衍生菌株)作為新食品投放市場。本法規自2023年6月4日起正式生效。
申報公司: 科漢森/Chr. Hansen A/S(丹麥)
自2023年6月4日起的五年內,僅科漢森有權在歐盟市場銷售6’-唾液酸乳糖鈉鹽(來源:大腸桿菌BL21 (DE3)衍生菌株),除非:
1. 后續申請人的申報材料符合(EU)2015/2283第26條規定,未參考科漢森納入數據保護的專有科學依據或數據;
2. 后續申請人獲得科漢森的授權。
批準使用范圍和用量見下:
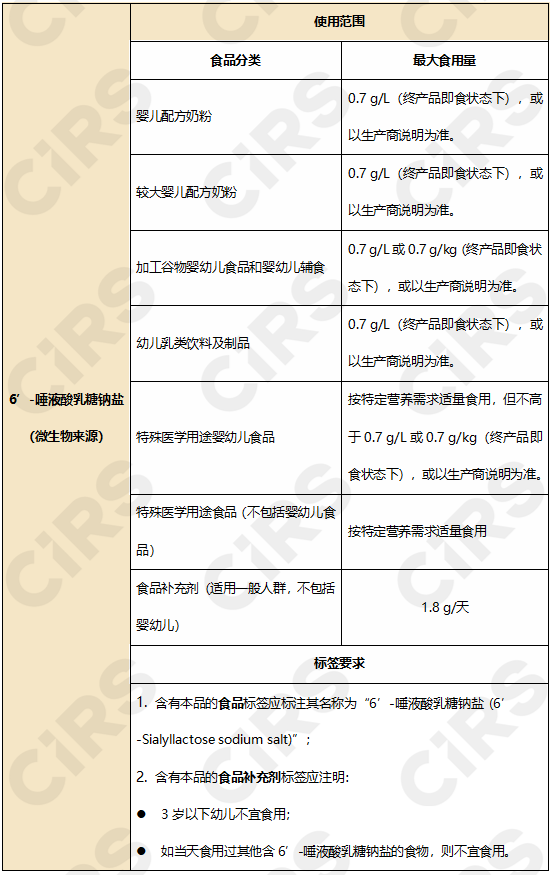
3. 酪蛋白酸鐵(Iron milk caseinate )
2023年5月15日,歐盟委員會發布新條例(EU) 2023/949,根據歐洲議會和理事會法規(EC) No 2015/2283,批準酪蛋白酸鐵作為新食品投放市場。本法規自2023年6月4日起正式生效。
申報公司: 雀巢/Société des Produits Nestlé S.A.(瑞士)
自2023年6月4日起的五年內,僅雀巢有權在歐盟市場銷售酪蛋白酸鐵,除非:
1. 后續申請人的申報材料符合(EU)2015/2283第26條規定,未參考雀巢納入數據保護的專有科學依據或數據;
2. 后續申請人獲得雀巢的授權。
批準使用范圍和用量見下:
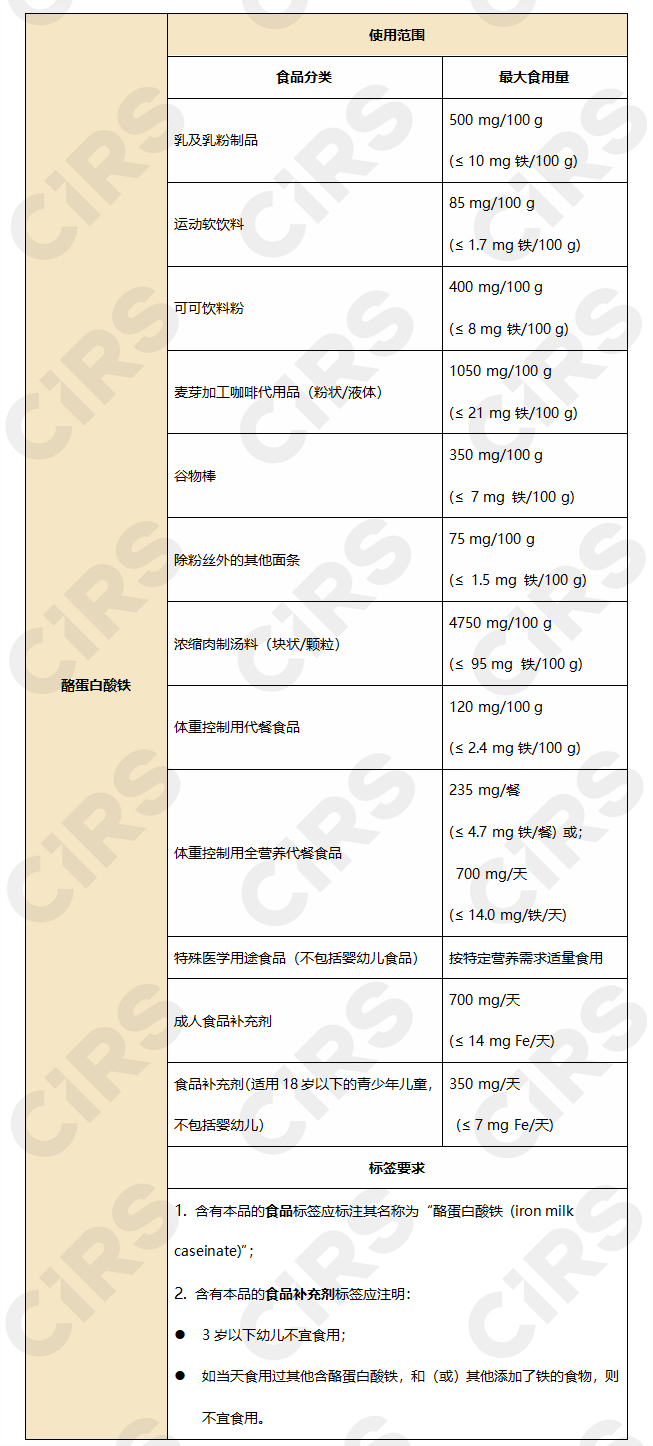
4. 卡琪花蒂瑪50%乙醇提取物(Aqueous ethanolic extract of Labisia pumila)
2023年5月17日,歐盟委員會發布新條例(EU) 2023/972,根據歐洲議會和理事會法規(EC) No 2015/2283,批準卡琪花蒂瑪50%乙醇提取物作為新食品投放市場。本法規自2023年6月6日起正式生效。
申報公司:Medika Natura Sdn. Bhd.(馬來西亞)
自2023年6月6日起的五年內,僅Medika Natura Sdn. Bhd.有權在歐盟市場銷售卡琪花蒂瑪水醇提取物,除非:
1. 后續申請人的申報材料符合(EU)2015/2283第26條規定,未參考Medika Natura Sdn. Bhd.納入數據保護的專有科學依據或數據;
2. 后續申請人獲得Medika Natura Sdn. Bhd.的授權。
批準使用范圍和用量見下:
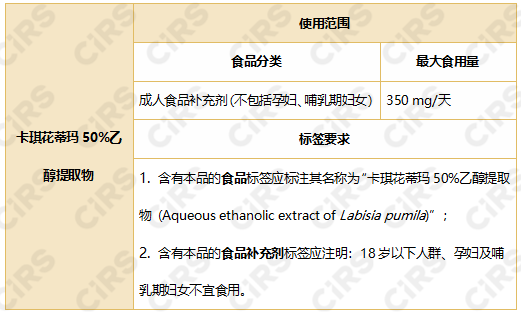
注:文內信息來源于歐盟官方公報(Official Journal of the European Union)。
相關推薦:
