根據國家市場監督管理總局發布的最新版本的《保健食品注冊與備案管理辦法》,保健食品在中國市場上市銷售前,企業需要申請并獲得保健食品注冊證書或備案憑證。使用保健食品原料目錄以外原料的國產保健食品和首次進口的保健食品(屬于補充維生素、礦物質等營養物質的保健食品除外)都需要向國家市場監管總局(SAMR)申請注冊。
保健食品在不同國家的名稱
中國: Health Food (保健食品)
歐盟: Food Supplement(食品補充劑)
美國:Dietary Supplement(膳食補充劑)
加拿大:Natural Health Product(天然保健品)
澳大利亞:Complementary Medicines(輔助藥類)
韓國: Health Functional Food(保健功能食品)
日本: Food with Health Claims (FHC)(保健聲稱食品)
在中國,什么是保健食品?
聲稱并具有特定保健功能或者以補充維生素、礦物質等營養物質為目的;
適用于特定人群食用;
具有調節機體功能,不以治療疾病為目的;
對人體不產生任何急性、亞急性或慢性危害;
不同于一般(普通)食物和藥品。
保健食品的類別
營養素補充劑: 補充維生素和(或)礦物質等營養物質,但無法提供能量或其它活性成分,不能聲稱任何保健功能。
功能性保健食品: 聲稱并具有特定保健功能且對人體具有生理效應。
功能性保健食品允許宣稱的24種功能
序號 | 保健功能名稱 | 序號 | 保健功能名稱 |
1 | 有助于增強免疫力 | 13 | 有助于改善黃褐斑 |
2 | 有助于抗氧化 | 14 | 有助于改善皮膚水份狀況 |
3 | 輔助改善記憶 | 15 | 有助于調節腸道菌群 |
4 | 緩解視覺疲勞 | 16 | 有助于消化 |
5 | 清咽潤喉 | 17 | 有助于潤腸通便 |
6 | 有助于改善睡眠 | 18 | 輔助保護胃粘膜 |
7 | 緩解體力疲勞 | 19 | 有助于維持血脂(膽固醇/甘油三酯)健康水平 |
8 | 耐缺氧 | 20 | 有助于維持血糖健康水平 |
9 | 有助于控制體內脂肪 | 21 | 有助于維持血壓健康水平 |
10 | 有助于改善骨密度 | 22 | 對化學性肝損傷有輔助保護作用 |
11 | 改善缺鐵性貧血 | 23 | 對電離輻射危害有輔助保護作用 |
12 | 有助于改善痤瘡 | 24 | 有助于排鉛 |
保健食品注冊相關法律法規
名稱 | 發行日期 | 施行日期 |
中華人民共和國食品安全法(2021年修訂版) | 2015.04.24(2021.04.29修訂) | 2015.10.01 |
2016.02.26(2020.11.03修訂) | 2016.07.01 | |
2014.12.24 | 2015.05.24 | |
2016.11.14 | 2016.11.14 | |
2016.12.19 | 2016.12.19 | |
2020.10.31 | 2020.10.31 | |
2020.10.31 | 2020.10.31 | |
2020.10.31 | 2020.10.31 | |
2023.08.31 | 2023.08.31 | |
2023.08.31 | 2023.08.31 | |
2023.08.31 | 2023.08.31 | |
2023.08.31 | 2023.08.31 | |
2019.08.20 | 2020.01.01 | |
2019.11.12 | 2019.11.12 |
哪些保健食品需要申請保健食品注冊?
國產:使用保健食品原料目錄以外原料的保健食品
進口:首次進口的保健食品(屬于補充維生素、礦物質等營養物質的保健食品除外)
PS. 保健食品原料目錄目前包含《保健食品原料目錄 輔酶Q10,破壁靈芝孢子粉,螺旋藻,魚油,褪黑素》 、《保健食品原料目錄 大豆分離蛋白》、《保健食品原料目錄 乳清蛋白》和《保健食品原料目錄 營養素補充劑(2023年版)》
保健食品注冊申請人資質要求
國產保健食品注冊申請人應當是在中國境內登記的法人或者其他組織。
進口保健食品注冊申請人應當是上市保健食品的境外生產廠商(境外生產廠商,是指產品符合所在國(地區)上市要求的法人或者其他組織)。
換言之,無論是國產的保健食品還是進口的保健食品,都允許委托生產。
保健食品注冊流程
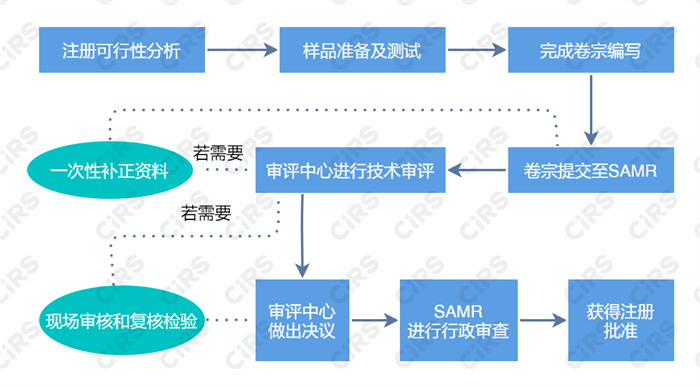
保健食品注冊材料要求
1) 保健食品注冊申請表,以及申請人對申請材料真實性負責的法律責任承諾書;
2) 注冊申請人主體登記證明文件復印件;
3) 產品研發報告,包括研發人、研發時間、研制過程、中試規模以上的驗證數據,目錄外原料及產品安全性、保健功能、質量可控性的論證報告和相關科學依據,以及根據研發結果綜合確定的產品技術要求等;
4) 產品配方材料,包括原料和輔料的名稱及用量、生產工藝、質量標準,必要時還應當按照規定提供原料使用依據、使用部位的說明、檢驗合格證明、品種鑒定報告等;
5) 產品生產工藝材料,包括生產工藝流程簡圖及說明,關鍵工藝控制點及說明;
6) 安全性和保健功能評價材料(包括三批次穩定性試驗報告,動物毒理試驗報告,動物功能試驗報告,人體試食試驗報告等);
7) 直接接觸保健食品的包裝材料種類、名稱、相關標準等;
8) 產品標簽、說明書樣稿;
9) 產品名稱中的通用名與注冊的藥品名稱不重名的檢索材料、產品名稱與批準注冊的保健食品名稱不重名的檢索材料;
10) 3個最小銷售包裝樣品;
11) 其他與產品注冊審評相關的材料。
申請首次進口保健食品注冊,還應當提交下列材料:
1) 產品生產國(地區)、政府主管部門或者法律服務機構出具的注冊申請人為上市保健食品境外生產廠商的資質證明文件;
2) 產品生產國(地區)政府主管部門或者法律服務機構出具的保健食品上市銷售一年以上的證明文件;
3) 產品生產國(地區)或者國際組織與保健食品相關的技術法規或者標準,保證生產質量管理體系有效運行的自查報告,符合良好生產質量管理規范的證明文件;
4) 產品在生產國(地區)上市的包裝、標簽、說明書實樣。
5) 由境外注冊申請人常駐中國代表機構辦理注冊事務的,應當提交《外國企業常駐中國代表機構登記證》及其復印件;境外注冊申請人委托境內的代理機構辦理注冊事項的,應當提交經過公證的委托書原件以及受委托的代理機構營業執照復印件。
保健食品注冊申報周期
從初期的資料準備和樣品檢測到官方審評,保健食品的注冊申報周期通常為2到3年。
我們的服務
瑞旭其他熱門服務:
相關閱讀:
