新修訂的食品安全法明確規定對保健食品實行嚴格監督管理。為規范統一保健食品管理工作,國家市場監督管理總局(原國家食品藥品監督管理總局)頒布了《保健食品注冊與備案管理辦法》、《保健食品注冊申請服務指南》和《保健食品注冊審評審批工作細則》等法律法規,明確了保健食品轉讓技術注冊的申請材料及要求。
什么是保健食品轉讓技術注冊?
保健食品轉讓技術注冊,是指保健食品批準證書的持有者,將產品生產銷售權和生產技術全權轉讓給其他法人或者組織,受讓方應當在轉讓方的指導下重新提出產品注冊申請,審評機構按照相關規定簡化審評程序,符合要求的,國家市場監督管理總局為受讓方核發新的保健食品注冊證書,并對轉讓方保健食品注冊證書予以注銷。
保健食品轉讓技術注冊申請材料
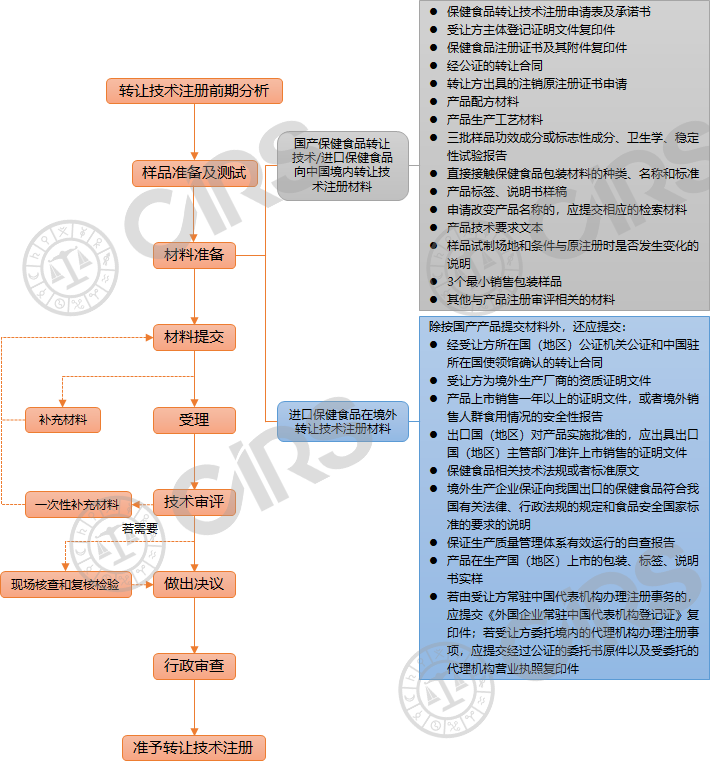
1.國產保健食品轉讓技術/進口保健食品向中國境內轉讓技術注冊申請材料
(1)保健食品轉讓技術注冊申請表,以及注冊申請人對申請材料真實性負責的法律責任承諾書;
(2)受讓方主體登記證明文件復印件;
(3)保健食品注冊證書及其附件復印件;
(4)經公證的轉讓合同;
(5)轉讓方出具的注銷原注冊證書申請;
(6)產品配方材料;
(7)產品生產工藝材料;
(8)三批樣品功效成分或標志性成分、衛生學、穩定性試驗報告;
(9)直接接觸保健食品的包裝材料的種類、名稱和標準;
(10)產品標簽、說明書樣稿;
(11)受讓方申請改變產品名稱的,應提交:
-
產品名稱中的通用名與注冊的藥品名稱不重名的檢索材料;
-
產品名稱與批準注冊的保健食品名稱不重名的檢索材料;
-
以原料或原料簡稱以外的表明產品特性的文字,作為產品通用名的,還應提供命名說明。
(12)產品技術要求文本;
(13)樣品試制場地和條件與原注冊時是否發生變化的說明;
(14)3個最小銷售包裝樣品;
(15)其他與產品注冊審評相關的材料。
2.進口保健食品在境外轉讓技術注冊申請材料
除應按國產產品提交相關材料外,還應提交:
(1)經受讓方所在國(地區)公證機關公證和中國駐所在國使領館確認的轉讓合同;
(2)產品生產國(地區)政府主管部門或者法律服務機構出具的受讓方為上市保健食品境外生產廠商的資質證明文件;
(3)產品生產國(地區)政府主管部門或者法律服務機構出具的保健食品上市銷售一年以上的證明文件,或者產品境外銷售以及人群食用情況的安全性報告;
(4)出口國(地區)對產品實施批準的,應還出具出口國(地區)主管部門準許上市銷售的證明文件;
(5)產品生產國(地區)或者國際組織與保健食品相關的技術法規或者標準原文;
(6)境外生產企業保證向我國出口的保健食品符合我國有關法律、行政法規的規定和食品安全國家標準的要求的說明;
(7)保證生產質量管理體系有效運行的自查報告;
(8)產品在生產國(地區)上市的包裝、標簽、說明書實樣;
(9)由受讓方常駐中國代表機構辦理注冊事務的,應當提交《外國企業常駐中國代表機構登記證》復印件;受讓方委托境內的代理機構辦理注冊事項的,提交經過公證的委托書原件以及受委托的代理機構營業執照復印件。
保健食品轉讓技術注冊應注意哪些問題?
(1)產品原料已經列入保健食品原料目錄,并符合相關技術要求,應當進行保健食品注冊轉備案申請。
(2)產品技術要求等材料,應與原注冊申請材料及注冊證書的相關內容一致,并符合現行規定、技術規范、國家標準等的規定。
(3)擬申請轉讓技術,若該產品正在辦理其他注冊事項,在完成相關注冊事項前,暫不受理該產品轉讓技術事項申請。
正在辦理轉讓技術注冊事項的產品,注冊申請人可同時提出變更或延續注冊申請。但變更或延續注冊申請受理的同時,轉讓技術注冊申請終止辦理。
(4)檢驗報告中樣品送檢單位應為受讓方。
(5)申報材料應同時加蓋轉讓方和受讓方的印章。
(6)對原料和主要輔料相同、口味或顏色不同的保健食品,若在新產品注冊時未開展安全性毒理學試驗和功能學評價試驗,申請轉讓技術注冊時,應當補做該兩類試驗。
保健食品轉讓技術注冊相關法規文件
-
《中華人民共和國食品安全法》及其實施條例
-
《保健食品注冊與備案管理辦法》
-
《保健食品注冊申請服務指南》
-
《保健食品注冊審評審批工作細則》
保健食品轉讓技術注冊流程
我們的服務
瑞旭其他熱門服務:
更多法規報告免費獲取:
- 免費獲取!2022年食品法規及行業熱點年度盤點報告 (點擊查看)
相關閱讀:
