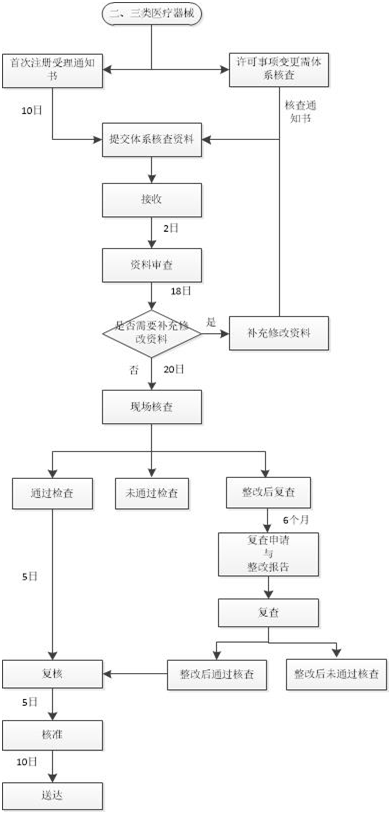
注冊質量管理體系核查流程如下圖:
申報資料:
(一)產品注冊受理通知書復印件
(二)注冊申請人基本情況表
(三)注冊申請人組織機構圖
(四)生產場地證明文件復印件
(五)總平面布置圖、生產區域分布圖
(六)對生產環境有凈化要求的,還應提供有資質的檢測機構出具的環境檢測報告復印件
(七)產品生產工藝流程圖
(八)主要生產設備和檢驗設備目錄
(九)質量管理體系自查報告
(十)擬注冊產品技術要求復印件
(十一)如屬于因產品注冊許可事項變更申請的體系核查,還應提交《體系核查通知》和相關注冊證明文件
(十二)注冊申請人資質復印件
(十三)有效版本的質量手冊、程序文件
注意事項:
1.對適用于同一醫療器械體系核查標準的產品,注冊申請人可合并申報體系核查資料;對適用于不同醫療器械體系核查標準的產品,注冊申請人應分別申報體系核查資料;
2.在體系核查現場,注冊申請人還應提供全部產品注冊申報資料,包括:
(1)醫療器械(不包括體外診斷試劑):研究資料、注冊檢驗報告、臨床試驗報告(如有)、醫療器械安全有效基本要求清單;
(2)體外診斷試劑:主要生產工藝及反應體系的研究資料(第三類體外診斷試劑)注冊檢驗報告、臨床試驗報告(如有)。
3.在產品首次注冊核查過程中,對注冊檢驗樣品和臨床試驗用樣品的真實性進行核查。重點查閱設計和開發過程實施策劃和控制的相關記錄、用于樣品生產的采購記錄、生產記錄、檢驗記錄和留樣觀察記錄等。
