 各有關單位:
各有關單位:
猴痘病毒核酸檢測試劑注冊審查指導原則
本指導原則旨在指導注冊申請人對猴痘病毒核酸檢測試劑注冊申報資料的準備及撰寫,同時也為技術審評部門提供參考。
本指導原則是對猴痘病毒核酸檢測試劑的一般要求,申請人應依據產品的具體特性確定其中內容是否適用。若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。
本指導原則是供注冊申請人和技術審評人員使用的指導性文件,但不包括審評審批所涉及的行政事項,亦不作為法規強制執行,應在遵循相關法規的前提下使用本指導原則。如果有能夠滿足相關法規要求的其他方法,也可以采用,但是需要提供詳細的研究資料和驗證資料。
本指導原則是在現行法規和標準體系以及當前認知水平下制定,隨著法規和標準的不斷完善,以及科學技術的不斷發展,相關內容也將適時進行調整。
一、適用范圍
本指導原則適用于采用實時熒光PCR法,對皮膚病變標本(包括病變皮疹、痘皰表面和/或滲出物的拭子,痘皰液,痘皰表皮或痘痂等)、咽拭子、全血或血清樣本等樣本中的猴痘病毒核酸進行體外定性檢測的試劑。
對于采用其他方法學的猴痘病毒核酸檢測試劑,可能部分要求不完全適用或本文所述內容不夠全面,申請人應參照本指導原則,根據產品特性對適用部分進行評價,并補充其他的評價資料。
本指導原則適用于猴痘病毒核酸檢測試劑注冊申請和變更注冊申請的情形。本指導原則針對猴痘病毒核酸檢測試劑注冊申報資料中的部分內容進行撰寫,其他未盡事宜應當符合《關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》等相關法規要求,同時建議參考《定性檢測試劑分析性能評估注冊審查指導原則》等適用的技術文件要求。
二、注冊審查要點
(一)監管信息
1.產品名稱及分類編碼
產品名稱應符合《體外診斷試劑注冊與備案管理辦法》及相關法規的要求,如猴痘病毒核酸檢測試劑盒(熒光PCR法)。根據《體外診斷試劑分類規則》,該產品按照第三類體外診斷試劑管理,分類編碼為6840。
2.其他信息還包括產品列表、關聯文件、申報前與監管機構的聯系情況和溝通記錄以及符合性聲明等文件。
(二)綜述資料
綜述資料主要包括概述、產品描述、預期用途、申報產品上市歷史及其他需說明的內容。應詳細說明產品所采用的技術原理及檢測流程。提供不同適用機型的檢測通量,即一次檢測最多可檢測的樣本數。提供核酸提取(手工和自動提取方式應分別明確)和PCR擴增的時間,以及檢測全過程所需的時間。不同檢測流程,分別提供最少和最多檢測樣本量下的檢測時間。與已上市同類產品進行比較,比較內容包括樣本類型,檢測原理,檢測靶基因,組成成分,內標,質控品,判讀規則,分析性能和臨床性能等。
預期用途中明確產品檢測的靶基因,需選擇保守性和特異性相對較高的基因,同時還應考慮基因的擴增效率。檢測基因的選擇應提供相關指南或文獻,并分析所檢測基因的靈敏度和特異性是否符合臨床需求。
(三)非臨床資料
1.分析性能研究
注冊申請人應采用在符合質量管理體系的環境下生產的試劑盒進行所有分析性能研究,提交具體研究方法、試驗方案、試驗數據、統計分析等詳細資料。
分析性能評估所用樣本的基本信息均需明確,例如樣本來源、樣本類型、采集和處理方式、稀釋方式、定值過程及數據等。研究中采用的猴痘病毒陽性樣本,應采用科學合理的方法確定其陰陽性和濃度水平,提交具體的試驗資料。分析性能評估用樣本一般應為真實樣本,可采用境內外樣本進行研究。如涉及稀釋后檢測,應采用與適用樣本類型一致的陰性基質。不可采用質粒、假病毒等,進行分析性能評估。對于各項性能中采用的樣本,在下述各項性能研究資料中分別提供樣本信息列表。精密度、檢出限和包容性研究中所用樣本應相互獨立。
1.1樣本穩定性
對采集后各階段的樣本進行穩定性研究,包括不同保存液、裂解液,不同滅活方式處理后的樣本,研究內容包括冷藏保存時間,冷凍保存時間,凍融次數等。
建議對每種樣本類型均進行穩定性研究,研究樣本應至少包含弱陽性和陰性樣本。
如核酸提取液可不立即進行檢測,還需對核酸提取液的保存條件和穩定性進行研究。
1.2適用的樣本類型
列明產品適用的樣本類型,如皮膚病變標本(包括病變皮疹、痘皰表面和/或滲出物的拭子,痘皰液,痘皰表皮或痘痂等)、咽拭子、全血或血清樣本,應分別進行分析性能評估。
1.3企業參考品驗證(如適用)
根據主要原材料研究資料中的企業參考品設置情況,采用三批產品對企業參考品進行檢驗并提供詳細的試驗數據。
1.4準確度
可采用方法學比對或參考品(盤)檢測的方法進行研究。
1.5精密度
應對精密度指標,如標準差或變異系數等的評價標準做出合理要求。應考慮運行、時間、操作者、儀器、試劑批次和地點等影響精密度的條件,設計合理的精密度試驗方案進行評價。精密度評價試驗應包含核酸提取步驟。設定合理的精密度評價周期,例如為期至少20天的檢測。對檢測數據進行統計分析,獲得重復性、實驗室內精密度、實驗室間精密度、批間精密度等結果。
采用臨床樣本或病毒培養物進行精密度評價,應至少包含3個水平:陰性樣本、臨界陽性樣本、中/強陽性樣本,并根據產品特性設定適當的精密度要求,例如:
陰性樣本:不含待測物,陰性檢出率應為100%(n≥20)。
臨界陽性樣本:待測物濃度略高于試劑盒的檢出限,陽性檢出率應≥95%(n≥20)。
中/強陽性樣本:待測物濃度呈中度到強陽性,陽性檢出率為100%且Ct值的CV≤5%(n≥20)。
1.6包容性
1.6.1采用生物信息學方法對產品檢測的包容性進行研究,研究應覆蓋權威數據庫中已公布的猴痘病毒核酸序列。
1.6.2驗證具有時間和區域特征性的至少10個不同來源的陽性樣本,包含分支 I、分支 II和重點亞分支及變異株。研究應包括檢出限和重復性的驗證。
1.7檢出限
1.7.1檢出限的確定
建議將不同來源的至少3個樣本系列稀釋于與適用樣本一致的基質中,進行檢出限的確定。每個濃度梯度重復檢測,記錄不同濃度檢出的結果,采用適當的模型(如Probit分析)和分析方法,將具有95%陽性檢出率的最低濃度水平作為確定的檢出限。申請人可采用數字PCR、標準曲線等方法進行毒株核酸濃度的確認,以copies/mL作為毒株濃度的表示方式。此外還可采用半數組織感染量測定法(TCID50)的方法進行毒株濃度確認,以TCID50/mL作為毒株濃度的表示方式。
1.7.2檢出限的驗證
選擇另外3例不同來源的猴痘病毒樣本在檢出限濃度水平進行驗證,應達到95%陽性檢出率。
如檢測試劑包括多個檢測靶標,應分別進行LOD研究。如采用毒株進行LOD研究,應將稀釋后毒株置于配套拭子上,以模擬實際檢測條件。
1.8分析特異性
1.8.1交叉反應
生物信息學分析:采用生物信息學分析方法進行研究,應當包括人基因組和所有已知病原體。
樣本驗證:交叉反應研究樣品除特殊說明外,應采用滅活的臨床樣本或添加了滅活病原體培養物的陰性臨床樣本,樣本基質應與預期檢測樣本類型一致,交叉反應研究用樣本主要考慮以下幾方面:
1.8.1.1其他近緣病毒:天花病毒(假病毒)、痘苗病毒、牛痘病毒、鼠痘病毒、傳染性軟疣病毒、特納河痘病毒(假病毒)、亞巴猴病毒(假病毒)等。
1.8.1.2引起出疹癥狀等的其他病原體:水痘-帶狀皰疹病毒、風疹病毒、單純皰疹病毒-1/-2、人類皰疹病毒 6、人類皰疹病毒 7、人類皰疹病毒8、麻疹病毒、腸道病毒、梅毒螺旋體、登革病毒、人乳頭瘤病毒等。
1.8.1.3適用樣本中可能存在的其他細菌/真菌等:金黃色葡萄球菌、化膿性鏈球菌、綠膿桿菌、白色念珠菌、糞腸球菌、丙酸桿菌、類白喉桿菌、銅綠假單胞菌、棒狀桿菌、大腸桿菌、生殖支原體、沙眼衣原體等。
1.8.1.4高濃度人類基因組DNA。
注:病毒培養液的濃度單位可采用TCID50或PFU/mL,細菌培養物濃度單位可采用CFU/mL。建議在病毒和細菌感染的醫學相關水平進行交叉反應的驗證。通常,細菌感染的水平為106 CFU/mL或更高,病毒為105 PFU/mL或更高。也可采用其他合理方法定值的濃度,例如核酸濃度107 copies/mL,如病原體樣本或培養物不能符合上述要求,申請人應詳細說明理由。對于某些難以培養或因為生物安全性無法培養的病原體,可采用病原體核酸樣本進行交叉驗證。應提供用于交叉反應驗證的病原體核酸的來源、組成和濃度等信息,濃度可采用copies/mL單位表示。
申請人應提供所有用于交叉反應驗證的病毒和細菌的來源、種屬/型別信息和濃度確認等試驗資料。
1.8.2干擾試驗
1.8.2.1內源/外源物質干擾
應根據所采集樣本類型,針對可能存在的內源/外源物質干擾情況進行驗證,驗證推薦物質見表1。建議申請人在每種干擾物質的潛在最大濃度(“最差條件”)條件下進行試驗,檢測包含臨界陽性水平在內的猴痘病毒樣本。對結果進行合理的統計分析,對比添加干擾物質前后的 Ct 值差異。檢測的潛在干擾物包括樣本中的原有物質及在樣本采集和處理期間引入的物質。
1.8.2.2病原體干擾
申請人應結合產品適用的樣本類型,充分考慮臨床上容易與猴痘病毒合并感染的病原體及“1.8.1”部分經生物信息學分析顯示存在較高同源性的病原體,在高濃度的情況下對低濃度(例如檢出限濃度)猴痘病毒核酸檢測的影響,進行易合并感染病原體的干擾研究。申請人也可結合臨床應用風險(如發病率),對較高同源性的病原體對檢測試劑可能存在的干擾進行分析。
1.9核酸提取/純化性能
對配合使用的所有核酸提取試劑進行提取核酸純度、濃度、提取效率的研究,并與質量較好的核酸提取試劑進行平行比對。若產品適用兩種或以上核酸提取試劑,則每一種核酸提取試劑均需配合檢測試劑至少進行抗干擾、再現性和檢出限的驗證,如果配套核酸提取試劑提取原理存在差異,還需額外進行檢出限的建立。
1.10反應體系
1.10.1樣本采集和處理
根據適用樣本類型,進行樣本采集研究。提供樣本采集器具和保存液等的詳細研究資料,明確保存液或裂解液等的成分、濃度、使用量的要求等。配套的不同保存液或裂解液需驗證檢出限和重復性。
提供樣本滅活、處理方式、處理過程的研究。
1.10.2核酸提取和反應體系
研究確定最佳核酸提取和反應體系,包括核酸提取用的樣本體積、洗脫體積和PCR加樣體積、各種酶濃度、引物/探針濃度、dNTP濃度、陽離子濃度及反應各階段溫度、時間、循環數等。建議在保證核酸提取質量的情況下盡量擴大總反應體系和加樣量,以提高檢測靈敏度。
提交不同適用機型基線和閾值循環數的確定資料。
不同適用機型的反應條件如果有差異應分別詳述,并提交驗證資料。
2.穩定性研究
申報試劑的穩定性主要包括實時穩定性(有效期)、開瓶穩定性、運輸穩定性、機載穩定性(如適用)及凍融次數限制等研究,申請人可根據實際需要選擇合理的穩定性研究方案。穩定性研究資料應包括具體的實施方案、詳細的研究數據以及統計分析結論。對于實時穩定性研究,應提供至少三批產品在實際儲存條件下保存至成品有效期后的研究資料。對于開瓶穩定性研究應模擬真實使用情形,包括開瓶穩定性的開瓶頻次和開瓶時間等。
3.陽性判斷值研究
陽性判斷值一般為申報產品檢測病毒核酸陽性的Ct值。陽性判斷值研究用樣本來源應具有多樣性和代表性,考慮不同時間、地域、不同的感染階段和生理狀態等因素,盡量納入較多弱陽性的樣本,陰性樣本應包含易交叉病原體高濃度樣本。在條件允許的情況下,建議覆蓋目前的流行株進行陽性判斷值研究。如判定值存在灰區,應提供灰區的確認資料。
如果產品適用不同樣本類型,需要對各樣本類型進行陽性判斷值的驗證。
提交陽性判斷值研究所用樣本的背景信息列表,至少包括性別、年齡、臨床診斷信息、樣本來源機構、檢測結果等信息。
提供內標檢測結果范圍的確定方法和研究資料。
4. 其他資料
4.1主要原材料研究資料
該類產品的主要原材料包括引物、探針、酶、dNTP、核酸分離/純化組分(如有)、質控品、企業參考品等。應提供主要原材料的選擇與來源、制備過程、質量控制標準等相關研究資料、質控品的定值試驗資料等。如主要原材料為企業自制,應提供其詳細制備過程;如主要原材料源于外購,應提供資料包括:選擇該原材料的依據及對比篩選試驗資料、供貨方提供的質量標準、出廠檢驗報告,以及該原材料到貨后的質量檢驗資料。供應商應固定,不得隨意更換。
4.1.1引物和探針:應詳述引物和探針的設計原則,提供引物、探針核酸序列、靶序列的基因位點及兩者的對應情況。建議每種病毒設計兩套或多套引物、探針以供篩選,通過序列比對和功能性試驗等方式,對病毒進行包容性和特異性(如交叉反應)的評價,其中序列比對包括與已公布猴痘病毒序列的比對,及與易產生交叉反應的其他病原體的序列比對;功能性試驗包括對不同來源、不同滴度的猴痘病毒核酸陽性樣本,和不同的近緣病原體的檢測。通過篩選確定最佳的引物和探針組合。引物、探針的質量標準應至少包括序列準確性、純度、濃度及功能性試驗等。
4.1.2脫氧三磷酸核苷(dNTP):包括dATP、dGTP、dCTP、dTTP、dUTP,應提供對其純度、濃度、功能性等的詳細驗證資料。
4.1.3酶:需要的酶主要包括DNA聚合酶、尿嘧啶DNA糖基化酶等,應分別對酶活性、功能性等進行評價和驗證。
4.1.4質控品
試劑盒一般包含陰性質控品和陽性質控品。陽性質控品應包含試劑盒檢測的靶序列,可采用假病毒或質粒制備。質控品需參與樣本處理、核酸的平行提取和檢測的全過程,以對整個提取和PCR擴增過程、試劑/設備、交叉污染等環節進行合理質量控制。提交試劑盒質控品有關原料選擇、制備、定值過程、濃度范圍等試驗資料,對質控品的檢測結果Ct值范圍做出明確的要求。
4.1.5內標
內標,又稱內對照,可對管內抑制導致的假陰性結果進行質量控制,應與靶核酸一同提取及擴增。申請人需對內標的引物、探針設計和相關反應體系的濃度做精確驗證,既要保證內標熒光通道呈明顯的陽性曲線又要盡量降低對靶基因檢測造成的抑制。明確內標的檢測結果Ct值范圍。建議科學設置內標,對待測樣本的取樣質量、試劑的反應體系進行監控。
4.1.6企業參考品
該類產品的企業參考品一般包括陽性參考品、陰性參考品、檢出限參考品和精密度參考品。應根據產品性能驗證的實際需要設置企業參考品。
應提交企業參考品的原料來源、選擇、制備、陰陽性及濃度確認方法或試劑等相關驗證資料。企業參考品應采用臨床樣本,或者使用病毒培養物加入陰性基質。企業參考品的設置建議如下:
陽性參考品:應著重考慮不同來源的病毒樣本和濃度要求,應至少選取不同來源的5個病毒樣本。
陰性參考品:主要涉及對交叉反應的驗證情況,建議包括水痘-帶狀皰疹病毒、風疹病毒、單純皰疹病毒、人類皰疹病毒、天花病毒(假病毒)、痘苗病毒、牛痘病毒、化膿性鏈球菌、白色念珠菌等。
檢出限參考品:可采用95%陽性檢出水平或略高于檢出限的水平,如100%陽性檢出水平。
精密度參考品:建議包括高、低兩個濃度的樣本,其中一個濃度應為檢出限附近的濃度。
4.2生產工藝研究資料
介紹產品主要生產工藝,可用流程圖結合文字的方式表述。提交主要生產工藝的確定及優化研究資料。
(四)臨床評價資料
臨床試驗的開展、方案的制定以及報告的撰寫等均應符合相關法規及《體外診斷試劑臨床試驗技術指導原則》的要求,如相關法規、文件有更新,臨床試驗應符合更新后的要求。
1.臨床試驗機構
建議申請人在相關流行病學多發區域選擇臨床試驗機構,應是經備案的醫療器械臨床試驗機構(包括各級疾病預防控制中心)。臨床試驗機構數量應不少于3家,且具有分子生物學方法檢測的優勢,實驗操作人員應有足夠的時間熟悉檢測系統的各環節(儀器、試劑、質控及操作程序等),熟悉評價方案。在整個實驗中,試驗體外診斷試劑和對比方法均應處于有效的質量控制下,最大限度保證試驗數據的準確性及可重復性。
2.臨床試驗設計
2.1 與對比方法/試劑的比較研究
2.1.1申請人可采用核酸序列測定方法作為參比方法,驗證試驗體外診斷試劑檢測結果與核酸序列測定(測序)結果之間的一致性。臨床研究中應對選用的測序方法做詳細介紹,并對委托測序服務的機構(如涉及)資質和選擇依據作簡要說明或提供相關資料。
同時申請人應進行部分與病毒分離培養鑒定進行比對的臨床試驗。
2.1.2 如有已上市同類產品,臨床試驗可選擇已上市的同類產品作為對比試劑,對比試劑的選擇應考慮樣本類型、產品性能等方面應與試驗體外診斷試劑具有良好的可比性。
2.2 與臨床參考標準的比較研究
除上述比對試驗外,還應考慮試驗體外診斷試劑與臨床參考標準進行對比。臨床參考標準即按照國家衛生健康委員會發布的《猴痘診療指南》及《猴痘防控技術指南》等文件進行病例診斷的方法。
3.臨床試驗入組人群
臨床試驗的入組人群應為產品的預期適用人群,該產品的適用人群為猴痘的疑似病例,申請人在進行臨床試驗時應依據國家衛生健康委員會發布的《猴痘診療指南》中對“疑似病例”的定義,按照該定義入組病例進行臨床研究。同時還應入組部分需要進行鑒別診斷的其它發熱出疹性疾病,如水痘、帶狀皰疹、單純皰疹、麻疹、登革熱等進行特異性的評價。如試驗體外診斷試劑包括血液樣本類型,應注意針對該樣本類型,入組人群應為急性期發病7日內的病例。
4.臨床試驗樣本類型
臨床樣本的采集建議按照《猴痘病毒實驗室檢測技術指南》進行。
如申報產品適用于不同的樣本類型,如皮膚病變標本(包括病變皮疹、痘皰表面和/或滲出物的拭子;痘皰液;皮疹或痘皰表皮、皮疹內液體拭子;痘痂或硬皮等)、咽拭子、全血或血清樣本,應在臨床試驗中分別進行臨床評價。針對全血和血清兩種樣本類型,申請人可通過同源比對的方式進行評價。樣本類型的選擇,應參考國家衛生健康委員會發布的《猴痘診療指南》及《猴痘防控技術指南》等文件的相關要求。
5.臨床試驗樣本量
與對比方法/試劑比較研究的臨床試驗樣本量應滿足統計學要求,可采用適當的統計學方法進行估算。臨床試驗可依據試驗用體外診斷試劑相對于對比方法的陰陽性符合率分別估算最低陰陽性樣本例數。
臨床樣本量的估算建議采用如下樣本量公式計算,
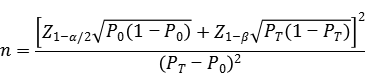
公式中,n為樣本量;Z1-α/2、Z1-β為顯著性水平和把握度的標準正態分布的分數位,P0為評價指標的臨床可接受標準,PT為試驗體外診斷試劑評價指標預期值。
其中,陰陽性符合率的臨床可接受標準(P0)建議不低于90%。獲得臨床試驗數據后,證明產品相對于對比方法的陰陽性符合率(置信區間下限)不低于預設的臨床可接受標準(P0)。當評價指標P接近100%時,上述樣本量估算方法可能不適用,應考慮選擇更加適宜的方法進行樣本量估算和統計學分析,如精確概率法等。
如申報試劑包含不同樣本類型,建議針對皮膚病變標本、咽拭子、血液樣本分別按照上述方法進行統計學估算。應注意每種皮膚病變標本均應有一定陽性例數。其中皮疹/痘皰表面拭子可能陽性檢出率較低,如臨床試驗中未能入組到充分的陽性例數,建議在說明書中對于該樣本類型的局限性進行提示。
病毒分離培養應入組一定數量的陽性及陰性病例,考察試驗體外診斷試劑與病毒分離培養結果的一致性,納入的例數也應進行統計學估算,可采用抽樣精度的公式進行樣本量估算。
與臨床參考標準的比較研究,建議參考與對比方法/試劑比較研究部分的樣本量估算方法,設定合理的臨床可接受標準。
6.臨床試驗結果的統計分析
此類產品的臨床試驗目的在于驗證試驗體外診斷試劑與已上市同類產品及臨床參考標準的一致性,統計分析一般以四格表的形式對結果進行總結,并據此計算試驗體外診斷試劑與對比方法的陽性/陰性符合率、臨床靈敏度、臨床特異度及其置信區間。應將試驗體外診斷試劑與對比方法檢測結果一致性、試驗體外診斷試劑檢測結果與臨床參考標準的一致性、試驗體外診斷試劑檢測結果與病毒分離培養鑒定結果的一致性分別進行統計分析,以評價產品臨床性能。
臨床試驗建議對入組人群的人口學進行分析,包括年齡、性別、臨床診斷背景等。臨床試驗中包含不同樣本類型的,應在總體統計分析的基礎上,每個樣本類型分別進行統計分析。
臨床試驗中所有不一致結果均應結合患者的流行病學背景、臨床癥狀、疾病轉歸等信息進行充分的分析。
7. 境外臨床試驗數據的認可
境外臨床試驗數據應符合《接受醫療器械境外臨床試驗數據技術指導原則》和《使用體外診斷試劑境外臨床試驗數據的注冊審查指導原則》的相關要求。提交完整的臨床試驗方案、報告和倫理審查意見,以及該數據適用于中國患者人群的論證資料、境內外臨床試驗質量管理差異的對比資料和臨床試驗質量管理差異對于臨床試驗結果影響的論證資料。
注冊申請人應根據上述臨床試驗技術審評要求,論證境外臨床試驗數據的充分性。
8. 臨床證據的形式要求
申請人應按照《體外診斷試劑注冊與備案管理辦法》、《關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》等法規文件要求提交各機構倫理審查意見、臨床試驗方案、臨床試驗小結、臨床試驗報告以及臨床試驗數據庫。
臨床試驗數據匯總表作為臨床試驗報告的附件提交。數據表中應包括檢測病例的編號、年齡、性別、樣本類型、臨床診斷結果、發病時間、試驗體外診斷試劑檢測結果(含各基因的Ct值)、對比方法的檢測結果(各基因的Ct值)等,如臨床試驗中所用樣本為核酸提取液,應明確該樣本樣本保存液(如涉及)、核酸提取試劑等。臨床應用的數據集中每一病例編號應能夠溯源。
關于測序試驗,申請人應提供以下關于測序部分的詳細試驗資料,需有臨床試驗單位的簽章確認。
(五)產品說明書和標簽樣稿
產品說明書格式應滿足《體外診斷試劑說明書編寫指導原則》的要求。產品說明書中技術內容應與注冊申報資料中的相關研究結果保持一致,如某些內容引用自參考文獻,應以規范格式進行標注,并單獨列明文獻的相關信息。猴痘病毒核酸檢測試劑說明書編寫應重點關注以下內容。
1.【預期用途】
本試劑盒用于體外定性檢測猴痘疑似病例、其他需要進行猴痘病毒感染診斷或鑒別診斷者的xx樣本中猴痘病毒核酸。
有關“疑似病例”等人群的定義參照《猴痘診療指南》及《猴痘防控技術指南》等文件執行。
該產品在使用上應當遵守《猴痘診療指南》及《猴痘防控技術指南》等文件的相關要求。
開展猴痘病毒核酸檢測,應符合《猴痘病毒實驗室檢測技術指南》等的要求,做好生物安全工作。
本試劑盒檢測結果僅供臨床參考,不得作為臨床診斷的唯一標準。建議結合患者臨床表現和其他實驗室檢測對病情進行綜合分析。
2.【檢驗原理】
簡述產品的核酸提取和擴增原理,檢測能夠覆蓋的目標基因序列特征。明確內標基因名稱及其作用。如采用了防污染措施,進行簡要描述。
3.【主要組成成分】
明確試劑盒中各組分及具體成分。明確需要但未提供的材料,例如核酸提取試劑,病毒保存液等的產品名稱,生產廠家,貨號及注冊證號、備案號等信息。
4.【樣本要求】
需詳細描述樣本采集和處理方式,包括采樣步驟,適用的拭子材質(如適用),保存液及使用體積、適用的抗凝劑類型(如適用),滅活方式等。描述樣本及核酸提取液的保存穩定性。
5.【檢驗方法】
明確核酸提取用的樣本體積、洗脫體積和PCR加樣體積,陰、陽性質控品與待測樣本同步進行核酸提取操作。明確各適用機型的反應參數設置。明確質控品和內標的檢測結果Ct值范圍,作為實驗有效性的標準。
6.【檢驗結果的解釋】
通過擴增曲線和Ct值進行結果陰陽性的判斷,列明結果陰性、陽性、復測、無效等所有情形。
7.【檢驗方法的局限性】
7.1本試劑盒的檢測結果僅供臨床參考,對患者的臨床診治應結合其癥狀/體征、病史、其他實驗室檢查及治療反應等情況綜合考慮。
7.2有關假陽性結果的可能性分析
7.2.1 如果樣本在運輸、處理過程中發生交叉污染,則可能導致假陽性結果;
7.2.2 實驗環境有PCR產物等氣溶膠污染,則可能導致假陽性結果;
7.2.3 實驗過程中使用的耗材、設備等受污染,則可能導致假陽性結果。
7.3有關假陰性結果的可能性分析
7.3.1不合理的樣本采集、轉運、儲存及處理、樣本中病原體含量過低均有可能導致假陰性結果;
7.3.2該病原體待測靶序列的變異或其他原因導致的序列改變可能會導致假陰性結果;
7.3.3 未經驗證的其他干擾或PCR抑制因子等可能會導致假陰性結果。
8.【產品性能指標】
簡述以下性能指標:
8.1國家標準品(如有)和企業參考品的符合率。
8.2檢出限:簡要介紹評價方法、所用樣本情況以及評價結果。
8.3對包容性的研究情況進行總結。包括不同分支樣本和猴痘病毒變異株的檢出限和重復性性能并描述猴痘病毒變異株生物信息學分析結果。
8.4對精密度的研究情況進行總結。
8.5分析特異性
8.5.1交叉反應:詳述交叉反應驗證的病原體種類,及有/無交叉反應的濃度水平。
8.5.2干擾試驗:說明驗證的干擾物質種類及有/無干擾反應的濃度水平。
8.6臨床試驗:簡要介紹試驗方法、受試者及樣本、試驗結果和結論等。
9.【注意事項】
9.1本產品僅用于體外診斷。
9.2臨床實驗室應嚴格按照《醫療機構臨床基因擴增實驗室管理辦法》等有關分子生物學實驗室要求。
9.3試劑保存運輸及使用過程中多種因素可能導致性能變化,如保存運輸不當、樣本采集、樣本處理及檢測過程操作不規范等,請嚴格按照說明書操作。因拭子等樣本采集過程及病毒感染過程本身的特點,可能存在采集到的樣本量不足等原因帶來的假陰性結果,應結合臨床其他診療信息綜合判斷,必要時復測。
9.4生物安全防護相關內容
9.5避免實驗室污染的措施
三、參考文獻
1.《體外診斷試劑注冊與備案管理辦法》(國家市場監督管理總局令第48號)[Z].
2.《關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》(國家藥品監督管理局公告2021年第122號)[Z].
3.中華人民共和國衛生健康委員會.猴痘診療指南(2022年版)[Z]2022-06-10
4. 中華人民共和國衛生健康委員會. 猴痘防控技術指南(2022年版)[Z]2022-06-27
四、起草單位
國家藥品監督管理局醫療器械技術審評中心
