各省、自治區、直轄市及計劃單列市、新疆生產建設兵團工業和信息化主管部門、藥品監督管理部門:
根據《關于組織開展生物醫用材料創新任務揭榜掛帥(第一批)工作的通知》(工信廳聯原函〔2022〕325號),經各地推薦、綜合評審和網上公示,確定了生物醫用材料創新任務揭榜掛帥(第一批)入圍揭榜單位名單,現予以公布。有關事項通知如下:
一、請入圍揭榜單位按照申報材料提出的攻關內容抓緊推進,確保揭榜任務按期保質完成。工業和信息化部會同國家藥品監督管理局將不定期抽查,依托國家產融合作平臺為入圍項目提供投融資對接服務,并優先提供審評相關的技術咨詢服務。
二、請各地工業和信息化主管部門會同藥品監督管理部門加強對入圍揭榜單位和項目的跟蹤和服務,結合區域產業優勢和臨床資源,加大對入圍揭榜單位和項目的支持,優先配置項目用地、用能、排污等指標資源,出臺鼓勵應用推廣的配套政策。
三、入圍揭榜單位完成攻關任務后(原則上名單公布之日起3年內),工業和信息化部、國家藥品監督管理局將委托相關專業機構開展測評,擇優確定揭榜優勝單位(每個揭榜產品原則上不超過2家)。鼓勵揭榜項目的相關材料以醫療器械主文檔形式進行登記,并通過新材料首批次應用保險補償等政策支持應用推廣。
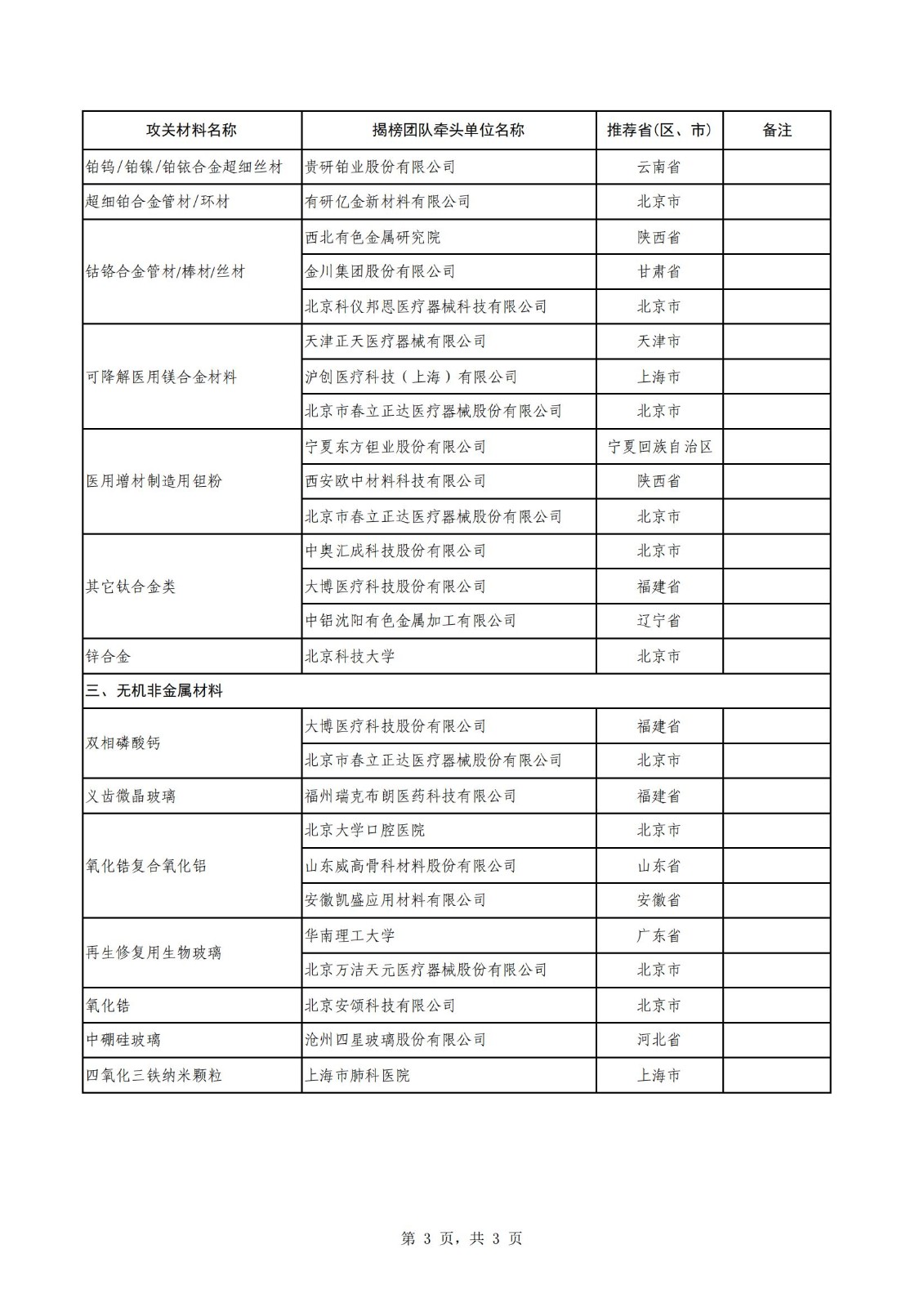
附件:生物醫用材料創新任務揭榜掛帥(第一批)入圍揭榜單位名單
工業和信息化部辦公廳
國家藥品監督管理局綜合和規劃財務司
2023年9月14日
對
于醫療器械原材料生產企業,出于技術保密的需求,
難以將原材料相關研究信息提供給下游醫療器械生產商,為平衡技術保密與終端器械生產企業審評審批,醫療器械原材料生產企業可依據相關法規要求進行醫療器械主文檔登記事項。
登記的主文檔主要為醫療器械原材料
的研究資料
,如工藝驗證、化學表征、
生
物學
特性
、臨床研究等技術資
料
。
《關于公開征求醫療器械主文檔登記事項相關
文件
意見的通知》
《關于醫療器械主文
檔登記事
項公告》(以下簡稱《公告》)
點擊下方新聞,了解更多關于醫療器械主文檔登記信息。
生物醫用材料創新任務揭榜掛帥(第一批)入圍揭榜單位名單


掃描下方的二維碼訂閱“
CIRS醫械合規動態
”!實時傳遞最新醫療器械監管法規動態,分享醫療器械注冊成功經驗及經典案例跟蹤醫療器械最新產品安全與法規監管動態,獲得最新一手資訊。

① 凡本網注明"稿件來源:“杭州瑞旭科技集團有限公司"的所有文字、圖片和音視頻稿件,版權均屬杭州瑞旭科技集團有限公司所有,任何媒體、網站或個人未經本網協議授權不得轉載、鏈接、轉貼或以其他方式復制發表。已經本網協議授權的媒體、網站,在下載使用時必須注明"稿件來源:杭州瑞旭科技集團有限公司",違者本網將依法追究責任。
② 本網未注明"稿件來源:杭州瑞旭科技集團有限公司 "的文/圖等稿件均為轉載稿,本網轉載出于傳遞更多信息之目的,并不意味著贊同其觀點或證實其內容的真實性。如其他媒體、網站或個人從本網下載使用,必須保留本網注明的"稿件來源",并自負版權等法律責任。如擅自篡改為"稿件來源:杭州瑞旭科技集團有限公司",本網將依法追究責任。如對稿件內容有疑議,請及時與我們聯系。
③ 如本網轉載稿涉及版權等問題,請作者在兩周內速來電或來函與杭州瑞旭科技集團有限公司聯系。




