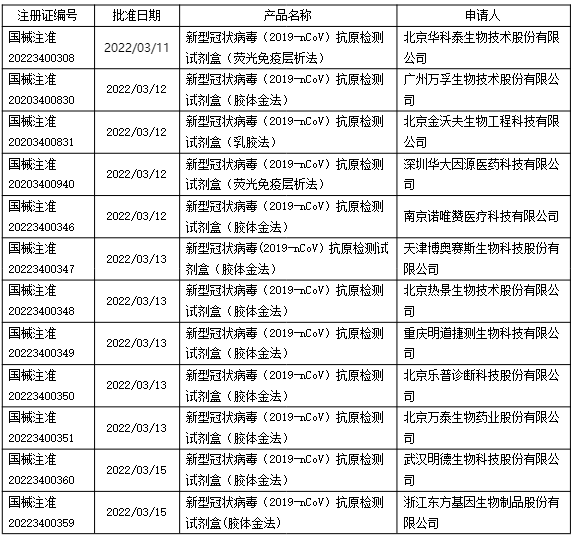
近期,疫情再次在國內蔓延,為了緩解新冠病毒檢測壓力,優化新冠病毒檢測策略,3月11日,國家衛健委發布《新冠病毒抗原檢測應用方案(試行)》通知,首次明確了新冠病毒抗原自測的相關政策。目前國家局已陸續批準了12個新型冠狀病毒(2019-nCoV)抗原自測試劑盒,包括注冊變更(增加自測應用)和應急審批注冊。具體產品批準信息如下:
據了解,目前計劃申報新型冠狀病毒抗原檢測試劑盒的企業可以申請應急或者優先審批通道,與常規注冊流程相比,在審評時限上有了明顯縮短,同時還有專人指導。
一、應急審批通道注冊申報流程:
目前已經有上市的新型冠狀病毒抗原檢測試劑盒,但如果產品供應不能滿足突發公共衛生事件應急處理需要的話,還是有希望走應急審評通道的,但企業在申請應急申請之前應提前跟國家藥品監督管理局確認。
1.申請企業匯總擬申報產品的研制信息,告知所在地省、自治區、直轄市藥品監督管理局 。省藥監局會對擬申報產品的情況進行評估,并進行早期介入,及時指導注冊申請人開展相關申報工作。
2.申請企業編制《醫療器械應急審批申請表》、產品研究綜述資料及相關說明,提交到國家藥監局。 國家局會對擬申報產品是否符合應急審批的要求及研發成熟度、生產能力等進行評估,確認產品是否通過應急審批。最終結果會通知申請企業、相應技術機構和省、自治區、直轄市藥品監督管理局。
3.申請企業應在確認應急審批之日起90日內,按照注冊要求完成注冊申報資料準備,并獲得注冊申請受理。 注冊要求包括3個方面:(1)國家局對擬申報產品提出的注冊資料要求;(2)新型冠狀病毒抗原檢測試劑注冊技術審評要點(試行);(3)關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告(2021年第122號)。 企業需要注意的是: 企業提交注冊申報資料后,國家藥監局會進行立卷審查,立卷審查通過后,才會受理。所以,并不是企業提交注冊申報資料就會被受理,如果不符合立卷審查要求,會被受理發補。如果因為受理發補,企業補充資料的時間過久,導致未在90日內獲得注冊申請受理,國家局將不再按照應急審批辦理。這種情況下,企業可以再去嘗試走優先審批程序。
4.應急審批程序會加快注冊進度,但不會減少注冊環節。 企業提交注冊申報資料后,進入技術審評和體系核查階段。 體系核查時限: 對于應急審評產品,申請人所在地省、自治區、直轄市藥品監督管理局會在接到國家藥監局通知后2日內組織開展質量管理體系核查,并及時出具質量管理體系核查報告,提交國家藥監局醫療器械技術審評中心。 技術審評時限: 國家藥監局會在10日內完成技術審評;技術審評結束后,在3日內完成行政審批。
二、優先審批通道注冊申報流程:
如果應急審批通道走不通的話,可以嘗試走優先審批通道。
1.申請企業需要先將產品研發情況告知相應的省、自治區、直轄市藥品監督管理局。 省、自治區、直轄市藥品監督管理局會對相關醫療器械的研制情況進行評估,初審之后,省、自治區、直轄市藥品監督管理局再將擬申報產品信息報到國家局。
2.申請企業按照注冊要求完成注冊資料準備。 注冊要求包括4個方面:(1)國家局對擬申報產品提出的注冊資料要求;(2)新型冠狀病毒抗原檢測試劑注冊技術審評要點(試行);(3)關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告(2021年第122號);(4)醫療器械優先審批申報資料編寫指南(試行)(國家局2017年第28號通告附件)。
3.申請企業在向國家局提交注冊申請時,同步提交優先審批申請 。與應急審批不同的是,應急審批申請是在向國家局提交注冊申請前進行,優先審批申請是在向國家局提交注冊申請的同時進行的。
4.優先審批程序會縮短注冊審評時間,但不會減少注冊環節。 企業提交注冊申報資料后,國家藥監局會先進行立卷審查。立卷審查通過,正式受理后,器審中心會對優先審批申請進行審核,符合優先審批情形的,予以優先審批。 技術審評時限: 國家局會按照接收時間單獨排序,優先進行技術審評。 體系核查時限: 省級食品藥品監督管理部門優先安排醫療器械注冊質量管理體系核查。
企業想要走綠色通道進行申報的話,現在就必須要加快產品研發進度,盡快進行產品注冊檢驗、臨床評價及向所在地省、自治區、直轄市藥品監督管理局進行前期溝通。對于現在想要申報新型冠狀病毒抗原檢測試劑盒的企業,應該做哪些準備工作及有哪些注意事項,請見《申報新冠抗原檢測試劑盒企業應對策略》。
我們的服務
