為了指導企業更好地進行保健食品注冊和備案工作,保健食品備案管理信息系統和國家市場監督管理總局食品審評中心網站上多次發布保健食品常見問題與解答。瑞旭集團特對這些內容進行匯總和梳理,形成保健食品常見問題與解答系列,供企業查閱。
往期內容回顧:
2、備案穩定性實驗如何執行?是否可以委托檢測?保健食品常見問題與解答——備案篇(2):理化檢驗及質量標準
3、 進口保健食品備案證明文件怎么出?保健食品常見問題與解答——備案篇(3):進口保健食品備案

本期內容:保健食品常見問題與解答——備案篇(4):其它。
1. 原注冊人產品轉備案流程(2017-7-4)
答:根據《保健食品備案工作指南(試行)》的要求,原注冊人產品轉備案的,應向總局保健食品審評中心提出申請。現將原注冊人資質確認具體事宜通知如下:
一、申請原注冊人資質確認應提交以下資料:
- 變更注冊申請表及申請人對申請材料真實性負責的法律責任承諾書 新保健食品注冊管理系統上線之前,請在總局保健食品審評中心網站下載專區獲取申報模板(點擊下載)下載專區/保健食品或(點擊下載)/下載專區/保健食品)
- 注冊轉備案申請書,應由法人代表簽字并加蓋申請人印章
- 營業執照、統一社會代碼/組織代碼等申請人主體登記證明文件復印件
- 保健食品注冊證書及其附件復印件(未獲注冊產品免于提供)
二、已獲注冊的產品轉備案申請流程:
已獲注冊的產品,注冊人按變更注冊向總局受理部門提出變更申請。
(一) 自本通知發布之日至新保健食品注冊管理系統正式上線之前
注冊申請人登錄保健食品備案管理信息系統(點擊注冊),點擊“獲取登錄賬號”,填寫賬戶信息,并勾選“原注冊人”,再填寫企業信息及已注冊產品信息,將所需資料掃描后上傳。已獲取登錄賬號的原注冊人,在賬戶首頁點擊“注冊轉備案申請”,填寫原注冊產品的相關信息,將所需資料掃描后上傳。
申請人網上提交后,應同時將蓋有公章的一份上述紙質資料原件報送總局行政受理服務部門。
總局審評中心收到紙質資料后進行審核,審核結束后向申請人填寫的聯系電話發出告知短信,并提示申請人可在備案管理信息系統中查看審核結果。符合原注冊人要求的,總局審評中心將原注冊產品電子信息轉送各省級食品藥品監督備案管理部門,各省級局可按規定發放登錄賬號;已獲取登錄賬號的原注冊人可直接在備案管理信息系統中申請產品備案。
(二) 新保健食品注冊管理系統正式上線之后
注冊人首先在保健食品注冊管理系統中按變更注冊要求提出“注冊轉備案”變更申請,在獲得國家食品藥品監督管理總局確認原注冊人資質的《未獲批準通知書》后,以原注冊人身份向備案管理部門提出備案管理信息系統登錄賬號申請(已有登錄賬號的除外)和產品備案申請。
三、《保健食品原料目錄》發布之前受理的注冊產品申請流程
《保健食品原料目錄》(以下簡稱《原料目錄》)發布前受理的新產品注冊申請、延續注冊申請、變更注冊申請、轉讓技術注冊申請,注冊申請人可按補充資料要求直接向審評中心提出變更申請,獲得原注冊人資質確認的可按照第二條相關流程進行產品備案。
四、存在以下情形之一的,不予確認原注冊人資質:
(一)不符合《辦法》《指南》等對原注冊人要求的;
(二)主體證明文件與注冊證書相關信息不一致、或未能提供相一致證明材料的;
(三)無特殊原因未在規定時限內提出注冊轉備案變更申請的;
(四)《原料目錄》發布后受理的新產品注冊申請,其原料已列入原料目錄,且符合備案相關技術要求的;
(五)新產品注冊申請已作出不予注冊決定的;
(六)因保健功能、安全性和質量可控性等原因已作出不予延續注冊決定的;
(七)注冊證書存在真實性問題的;
(八)其他不屬于注冊轉備案管理的情形;
本流程自發布之日起施行。
2. 國產保健食品生產企業如何申請備案?(2017-09-28)
答:國產保健食品備案人是生產企業的,可參照下列情況申請登錄賬號,進行產品備案:
- 備案人未持有符合備案要求的保健食品注冊證書的,應直接在備案管理系統中選擇備案類型為“國產保健食品”,原注冊人選項為“否”。
- 備案人持有符合備案要求的保健食品注冊證書的,可以以非原注冊人身份申請登錄賬號后,對新產品進行備案,或對注冊轉備案產品進行備案;也可以在獲得原注冊人資質后,以原注冊人的身份申請登錄賬號。
國產保健食品生產企業申請登錄賬號時,應同時上傳生產許可證等主體登記證明文件。
3. 同一個產品選用不同的內包裝材料時應如何提交備案的相關資料?(2018-03-09)
答:備案人擬選用兩種或以上直接接觸產品的包裝材料時,如果產品新申請備案,除在產品技術要求的“直接接觸產品包裝材料的種類、名稱及標準”中注明不同的包裝材料外,還應該對使用不同包裝材料生產的產品分別出具相應所有的檢驗報告。已獲得備案憑證的產品擬增加直接接觸產品的包裝材料時,應該按照備案變更的程序提交相關變更材料。
4. 備案保健食品信息填報流程圖(2019-03-26)
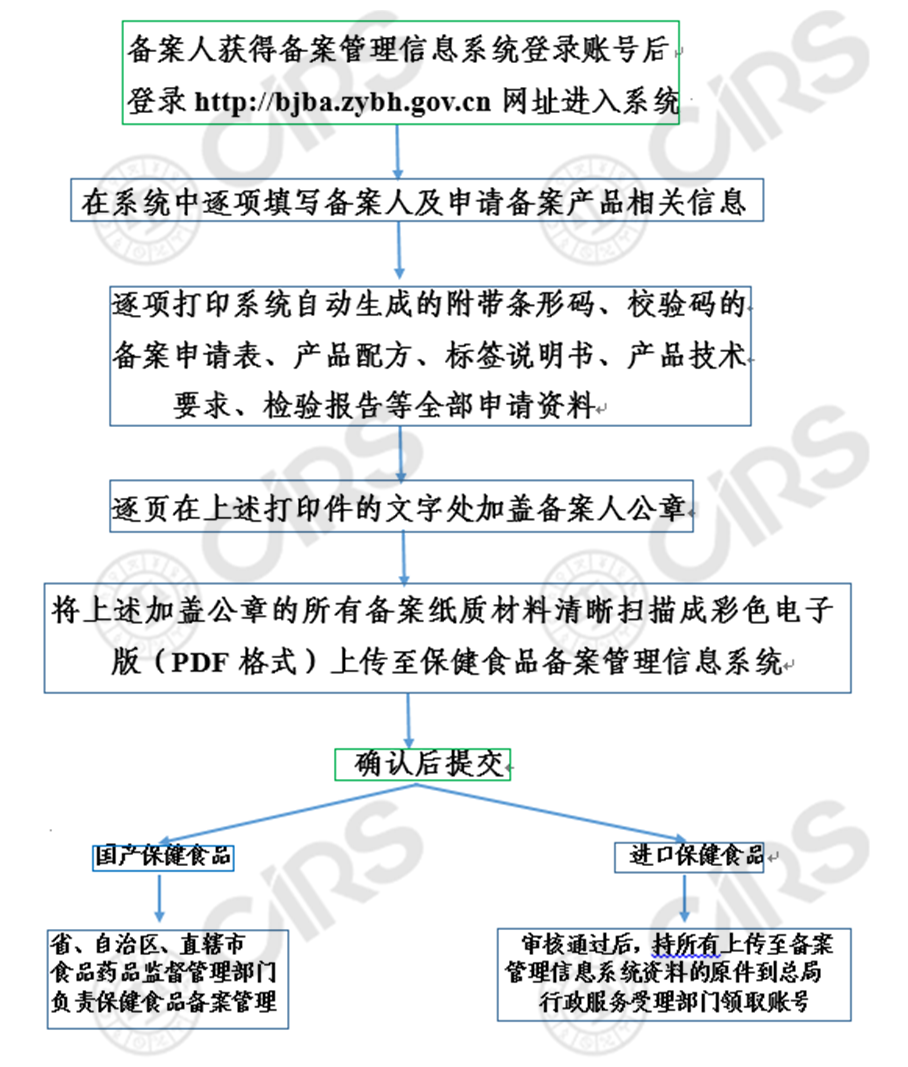
注:
1.問答來源:國家市場監督管理總局保健食品備案管理信息系統;
2.每個問題后括號中備注的日期為國家食品審評中心發布該問答的具體時間,以供參考;
3.“國家食品藥品監督管理局”目前已改名為“國家市場監督管理總局”。
相關推薦:
- 保健食品常見問題與解答-備案篇(1):原輔料
- 備案穩定性實驗如何執行?是否可以委托檢測?保健食品常見問題與解答——備案篇(2):理化檢驗及質量標準
- 進口保健食品備案證明文件怎么出?保健食品常見問題與解答——備案篇(3):進口保健食品備案
- 定了!境外生產企業注冊2個重要節點,2022年1月1日啟運,2022年1月1日生產
- 18類外進口食品如何申請境外生產企業注冊?
- 2021年上半年保健食品注冊類產品批件發布情況分析
- 瑞旭再傳捷報!17款進口保健食品備案產品發布,近半數由瑞旭申報成功!
我們的服務:
