根據國家市場監督管理總局關于發布《允許保健食品聲稱的保健功能目錄 非營養素補充劑(2023年版)》及配套文件的公告,對于已經列入保健功能目錄,但功能聲稱用語為舊的保健功能(比如:免疫調節,改善睡眠),注冊申請人需根據新舊保健功能聲稱銜接和最新評價要求進行轉化。
基于上述公告,保健食品“清理換證”工作正式啟動:大量已注冊的老批件(尤其是衛生部時期的批件),需要在規定時限內,按照要求重做或補做功能試驗,通過變更申請的方式獲取新的注冊證書。公告設置5年過渡期,老批件持有人需在5年內完成保健功能聲稱的轉化和規范。
哪些老批件需要重做或補做功能試驗,申請變更注冊?
根據要求,同時滿足以下兩個條件的已注冊產品,需要按照要求重做或補做功能學試驗項目,然后申請變更注冊。符合要求的,國家市場監督管理總局將為申請人換發新的注冊證書:
1)原功能學評價依據為《保健食品功能學評價程序和檢驗方法(1996版)》的;
2)同時,產品功能屬于表1中所列的8大類保健功能的。
表1 八大類需要重新補充或重做功能實驗的老批件
序號 | 原保健功能聲稱 | 現保健功能聲稱 | 原功能學評價依據為96年版評價方法的,需重做或補做的功能試驗 |
1 | 免疫調節、增強免疫力 | 有助于增強免疫力 | 重做動物功能試驗 |
2 | 延緩衰老、抗氧化 | 有助于抗氧化 | 補做人體試食試驗 |
3 | 改善記憶、輔助改善記憶 | 輔助改善記憶 | 人體試食試驗使用韋氏記憶量表的,重做人體試食試驗 |
4 | 抗疲勞、緩解體力疲勞 | 緩解體力疲勞 | 運動試驗為爬桿試驗的,重做動物功能試驗 |
5 | 耐缺氧、提高缺氧耐受力 | 耐缺氧 | 重做動物功能試驗 |
6 | 減肥 | 有助于控制體內脂肪 | 重做功能學試驗 |
7 | 調節血脂(降低總膽固醇、降低甘油三酯)、輔助降血脂 | 有助于維持血脂(膽固醇/甘油三酯)健康水平 | 重做人體試食試驗 |
8 | 抗輻射、對輻射危害有輔助保護作用 | 對電離輻射危害有輔助保護作用 | 重做動物功能試驗 |
變更注冊的資料要求
1. 國產保健食品變更注冊
1) 保健食品變更注冊申請表,以及注冊申請人對申請材料真實性負責的法律責任承諾書
2) 注冊申請人主體登記證明文件復印件
3) 注冊證書及其附件復印件
4) 變更前后的具體事項、變更的理由和依據
5) 與變更事項相關的具體資料
2. 進口保健食品變更注冊
除應按國產產品提交相關材料外,還應提交:
1) 產品生產國(地區)政府主管部門或者法律服務機構出具的注冊申請人為上市保健食品境外生產廠商的資質證明文件
2) 產品生產國(地區)政府主管部門或者法律服務機構出具的保健食品上市銷售一年以上的證明文件,或者產品境外銷售以及人群食用情況的安全性報告
3) 出口國(地區)對產品實施批準的,應出具出口國(地區)主管部門準許上市銷售的證明文件
4) 產品生產國(地區)或者國際組織與保健食品相關的技術法規或者標準原文
5) 變更后的產品包裝、標簽、說明書實樣
6) 由境外注冊申請人常駐中國代表機構辦理注冊事務的,提交《外國企業常駐中國代表機構登記證》及其復印件;境外注冊申請人委托境內的代理機構辦理注冊事項的,提交經過公證的委托書原件以及受委托的代理機構營業執照復印件
7) 產品生產國(地區)政府主管部門或者法律服務機構出具的申請事項已變更的證明文件及相關資料
這類批件在變更注冊過程中需要注意哪些事項?
1. 變更注冊時,申請人應按照現行法規要求對原標簽說明書樣稿、產品技術要求的內容進行更新;
2. 產品名稱應符合《保健食品命名指南(2019年版)》等相關規定。若已批準保健食品的名稱不符合要求的,應申請更名;
3. 涉及開展保健功能評價試驗的,應同時提供具有法定資質的檢驗機構出具的試驗用樣品的衛生學試驗報告。需進行人體試食試驗的,還應提供倫理審查批件以及人群食用評價材料;
4. 若有需要,注冊申請人可同時申請多個事項的變更注冊申請。
這類產品變更注冊的流程
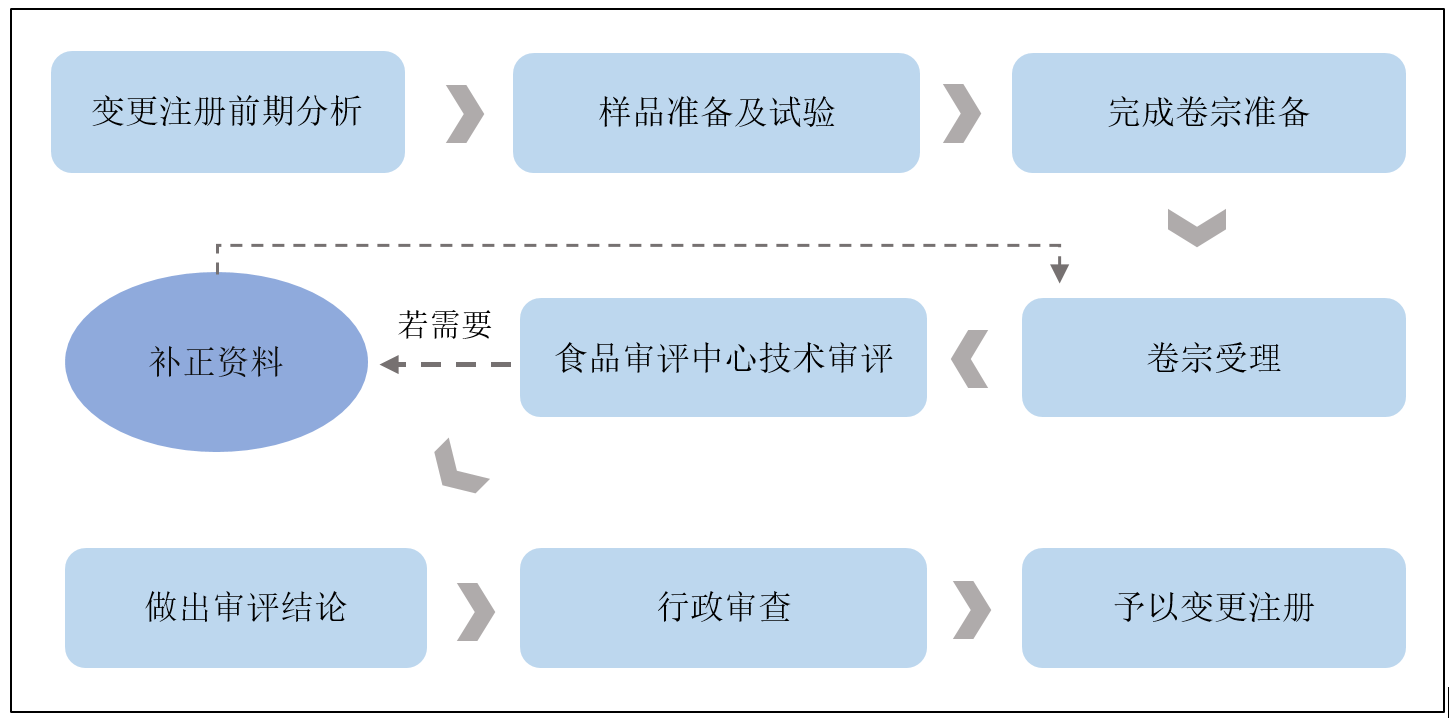
預估的變更注冊周期
從初期的資料準備和樣品檢測到官方審評,這類產品的變更注冊申報周期預期為1-2年。
我們的服務
瑞旭其他熱門服務:
更多法規報告免費獲取:
- 免費獲取!2022年食品法規及行業熱點年度盤點報告 (點擊查看)
相關閱讀:
- 保健食品熱點問題與解答
- 半年報—2023上半年保健食品注冊情況分析
- 保健食品如何設計配方配伍,注冊時需要提供什么資料?保健食品常見問題與解答——注冊篇(1):配方及原料
- 保健食品注冊檢驗有哪些要求?保健食品常見問題與解答——注冊篇(2):功能學和毒理學評價
- 保健食品滅菌工藝條件有哪些要點?穩定性試驗如何開展?保健食品常見問題與解答——注冊篇(3):產品生產工藝
- 保健食品技術要求和說明書有哪些注意事項?保健食品常見問題與解答——注冊篇(4):技術要求和說明書
- 保健食品受理環節有哪些注意事項?保健食品常見問題與解答——注冊篇(5):其他
