2016年03月15日~2016年03月17日,CFDA在深圳聯合舉辦有源醫療器械法規及審評技術要求高級培訓班。在培訓課程期間,劉露老師就針對醫療器械臨床評價指導原則機進行了深度的解析。
瑞旭技術專家參加了此次培訓,并整理了臨床評價指導原則深度解析的重點內容,現與大家一塊分享。
重點內容:一、列入《免于進行臨床試驗的醫療器械目錄》產品的臨床評價要求
- 免于臨床試驗的申報產品在與已上市同類產品進行對比時,要注意差異性這一項的填寫,(存在一定的差異性,不代表產品就不能豁免臨床或者需要用第二種途徑進行評價,主要還是看這個差異性的大小是否足以使用評價數據來論證。
- 免于臨床試驗的申報產品可以與多個已上市同類產品進行對比,以佐證產品的安全有效性。
- 臨床豁免目錄中的產品名稱大多數為某一類產品的統稱,申報產品的名稱不一定要和豁免目錄中一致才能取得豁免權。
- 提交申報產品與《目錄》中已獲準境內注冊醫療器械的對比說明,應注意相應支持性資料。
- 通過同品種醫療器械臨床數據進行臨床評價時,若同品種醫療器械產品與申報產品存在差異,那么差異的部分首先看是否可通過申報產品的非臨床研究資料、和/或臨床文獻數據、和/或臨床經驗數據、和/或針對差異性在中國境內開展的臨床試驗資料證明差異性對產品的安全有效性未產生不利影響,如果以上數據可以證明,則差異性的部分用這些數據來證明,而與同品種相同的部分通過對同品種醫療器械臨床文獻和/或臨床經驗數據進行收集、分析。從而得到臨床評價報告。
- 文獻檢索方式,一般以計算機檢索為主,輔以手工檢索和其他檢索。
- 文獻搜索中,經篩選納入臨床評價的文獻應提供全文。
- 文獻檢索原則:多渠道、多語種、全面獲得相關的原始數據。
- 臨床評價證據級別
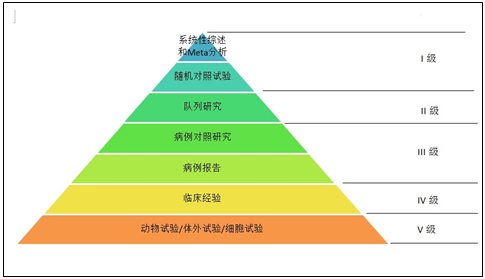
I級為最高級別,可信度最高。
6. 臨床評價數據,只有在可以合并時才需要meta分析,如果不能合并就不需要進行meta分析(定量分析)。這時做系統綜述也是可以的。
