隨著新型冠狀病毒肺炎疫情逐漸得到控制,各省份的醫療器械應急審批通道紛紛關閉。很多企業通過應急審批通道,順利拿到了防護類產品的應急審批注冊證。然而還有很多企業則錯過了應急審批期,仍然想去申報注冊醫用口罩、防護服等產品,此種情況下該如何申報,本文就此問題進行了回答,整理了醫用口罩、防護服等防護產品的注冊申報流程。
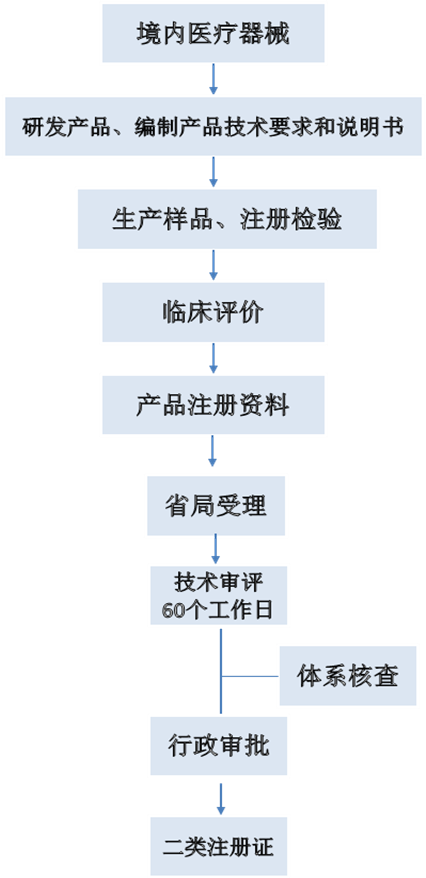
一、醫用口罩、防護服注冊審批流程圖
醫用口罩和防護服均為第二類醫療器械,需要向各省份的藥品監督管理局進行注冊申報。
二、醫用口罩、防護服注冊申報資料
每個省份對第二類醫療器械注冊申報的資料要求略有不同,企業應以各省份發布的相關政策為準,本文以浙江省為例,介紹口罩、防護服在申報注冊時應提交哪些資料。
|
序號 |
注冊資料 |
|
|
1 |
申請表 |
|
|
2 |
證明性文件 |
|
|
3 |
醫療器械安全有效基本要求清單
|
|
|
4 |
綜述資料
|
概述 |
|
產品描述 |
||
|
型號規格 |
||
|
包裝說明 |
||
|
適用范圍和禁忌癥 |
||
|
參考的同類產品或前代產品 |
||
|
其他需說明的內容 |
||
|
5 |
研究資料 |
產品性能研究 |
|
生物相容性評價研究 |
||
|
生物安全性研究 |
||
|
滅菌 / 消毒工藝研究(無菌產品) |
||
|
產品有效期和包裝研究 |
||
|
其他資料 |
||
|
6 |
生產制造信息 |
生產加工工藝 |
|
生產場地信息 |
||
|
7 |
臨床評價資料 |
|
|
8 |
產品風險分析資料 |
風險分析 |
|
風險評價 |
||
|
風險控制措施的實施和驗證 |
||
|
任何一個或多個剩余風險的可接受性評定 |
||
|
9 |
產品技術要求 |
|
|
10 |
產品注冊檢驗報告 |
注冊檢驗報告 |
|
預評價意見 |
||
|
11 |
產品說明書和最小銷售單元標簽樣稿 |
|
|
12 |
符合性聲明 |
|
三、醫用口罩的相關注冊信息
1. 分類
醫用口罩分為醫用防護口罩、醫用外科口罩、一次性使用醫用口罩。
2. 產品描述
醫用防護口罩: 由一種或多種對病毒氣溶膠、含病毒液體等具有隔離作用的面料加工而成的口罩。在呼吸氣流下仍對病毒氣溶膠、含病毒液體等具有屏障作用,且摘下時,口罩的外表面不與人體接觸。
醫用外科口罩 :通常由面罩、定形件、束帶等組件加工而成,一般由非織造布材料制造而成。通過過濾起到隔離作用。
一次性使用醫用口罩: 通常采用無紡布或無紡布復合材料制成,可為二層或三層結構,可有可塑性鼻夾,口罩帶為彈性或非彈性,具有過濾顆粒物和細菌等特性。
3. 預期用途
醫用防護口罩: 戴在醫療機構與病毒物料接觸的人員面部,用于防止來自患者的病毒向醫務人員傳播。
醫用外科口罩: 用于戴在手術室醫務人員口鼻部位,以防止皮屑、呼吸道微生物傳播到開放的手術創面,并阻止手術病人的體液向醫務人員傳播,起到雙向生物防護的作用。
一次性使用醫用口罩: 用于臨床各類人員在非有創操作過程中佩帶,覆蓋住使用者的口、鼻及下頜,為防止病原體微生物、顆粒物等的直接透過提供一定的物理屏障。
4. 技術指標
醫用防護口罩: 依據 GB 19083-2010 醫用防護口罩技術要求。
醫用外科口罩: 依據 YY 0469-2011 醫用外科口罩。
一次性使用醫用口罩: 依據 YY/T 0969-2013 一次性使用醫用口罩。
5. 可參考的指導原則
醫用口罩產品注冊技術審查指導原則( 2014 年第 7 號)
鏈接: https://www.cmde.org.cn/CL0112/6134.html
四、防護服的相關技術信息
1. 產品描述
由一種或多種對病毒氣溶膠、含病毒液體等具有隔離作用的面料加工而成的衣服。脫下時,防護衣的外表面不與人體接觸。
2. 預期用途
用于醫療機構醫護人員穿的職業防護衣。阻止來自患者的病毒隨空氣或液體向醫務人員傳播。
3. 技術指標
防護服:依據 GB 19082-2009 醫用一次性防護服技術要求。
