隨著 中國 近視人群的增加,隱形眼鏡的使用普及率也越來越高,同時也促進了隱形眼鏡護理 產業的發展 。臺灣的接觸鏡及其護理產品行業 發達, 占中國 大陸 市場份額相對較大 , 本文主要討論臺灣企業如何滿足中國大陸法規對于接觸鏡護理產品上市要求。
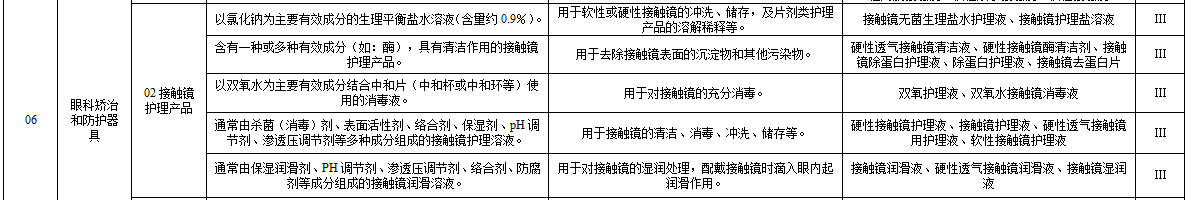
根據《醫療器械分類目錄》,接觸鏡護理產品的分類編碼為
16-06-02
,屬于第三類醫療器械管理,根據其功能的差異被
細
分為五
大
類。
 根據《免于進行臨床評價醫療器械目錄》,上述五種類型的接觸鏡護理產品只有鹽溶液可豁免臨床評價,其余功能的產品均需要進行臨床評價。臨床評價的方式有臨床試驗、同品種比對、使用境外臨床試驗數據、真實世界臨床試驗數據等途徑,企業可根據已有的臨床數據類型分析選擇。
根據《免于進行臨床評價醫療器械目錄》,上述五種類型的接觸鏡護理產品只有鹽溶液可豁免臨床評價,其余功能的產品均需要進行臨床評價。臨床評價的方式有臨床試驗、同品種比對、使用境外臨床試驗數據、真實世界臨床試驗數據等途徑,企業可根據已有的臨床數據類型分析選擇。
 在制定產品技術要求時,應參考《
YY 0719.2-2009
眼科光學 接觸鏡護理產品 第
2
部分:基本要求》進行制定
,同時
應對產品的外觀、
PH
、滲透壓、粘度、溶解時間、中和時間、裝量、與接觸鏡的物理相容性、有效成分、過氧化氫殘留量、清潔效率、微生物限度、抗微生物活性、防腐有效性及開瓶拋棄周期、有效期進行檢測。檢測方法參考《中國藥典》及
YY0719
系列標準。其中有效成分
、
清
潔效率
的
檢測方法應由企業提供,若無標準檢測方法的應提供方法學論證資料,目前
EDTA
、泊洛沙姆、環氧乙烯氫化蓖麻油成分的檢測方法可參考
YY0719.8
和
YY0719.9
。
在制定產品技術要求時,應參考《
YY 0719.2-2009
眼科光學 接觸鏡護理產品 第
2
部分:基本要求》進行制定
,同時
應對產品的外觀、
PH
、滲透壓、粘度、溶解時間、中和時間、裝量、與接觸鏡的物理相容性、有效成分、過氧化氫殘留量、清潔效率、微生物限度、抗微生物活性、防腐有效性及開瓶拋棄周期、有效期進行檢測。檢測方法參考《中國藥典》及
YY0719
系列標準。其中有效成分
、
清
潔效率
的
檢測方法應由企業提供,若無標準檢測方法的應提供方法學論證資料,目前
EDTA
、泊洛沙姆、環氧乙烯氫化蓖麻油成分的檢測方法可參考
YY0719.8
和
YY0719.9
。
接觸鏡護理產品應確定適用的接觸鏡的材料,應根據標準YY 0719. 5 進行鏡片相容性試驗, 試驗鏡片應每組不少于 10 片并包含極端頂焦度 。接觸鏡的材料組別詳見 GB/T11417.1(ISO 18369-1) ,但是硅水凝膠鏡片建單獨進行相容性試驗。
接觸鏡護理產品的抗微生物活性、防腐有效性和開瓶拋棄周期可在有效期研究中進行驗證,具體詳見《臺灣企業如何申報接觸鏡護理產品注冊(二)》。
接觸鏡護理產品的生物相容性研究應包括細胞毒性、皮膚刺激、眼刺激、急性經口毒性。 若采用新的眼用成分或不同的有效成分的產品(即國內已上市產品無該成分)還應進行皮膚致敏、兔眼相容性試驗以及防腐劑的攝入和釋放的測定。
接觸鏡護理產品的檢測應注意 典型性樣品的選擇可參考有效期研究中的典型性樣品 , 送檢樣品需要準備三個批次 ( 2:1:1 比例準備),建議提前溝通送檢規格及數量。防腐有效性研究根據防腐劑的種類、使用方法、適配的鏡片種類等的差異,其試驗樣品數量可能存在差異,送檢前應與試驗機構充分溝通,并需要準備防腐劑的標準品或具有溯源信息的對照品。目前,較為推薦的接觸鏡護理產品的檢驗機構為浙江省醫療器械檢驗研究院。
臺灣地區醫療器械企業可根據在臺灣地區 或其他國家上市時的已有資料評估上述研究項目是否需要重新開展。大陸的接觸鏡護理產品參考的標準等同于 ISO 標準,而臺灣 地區推行的接觸鏡護理產品標準也是參考 ISO 標準,故而基本可以直接采用已有的研究資料。而針對技術要求的檢測報告也可提交在臺灣 地區或其他國家有資質的第三方出具的報告及資質證明,企業具有相應檢驗能力的也可以提交自檢報告。
