在《臺灣醫療器械企業如何申報接觸鏡護理產品注冊(一)》中我們討論了國家藥監局(NMPA)對接觸鏡護理產品的基本法規要求,本文將主要針對有效期研究進行闡述以幫助臺灣地區醫療器械企業完成符合國家法規的有效期研究報告。
有效期研究一般可采用加速老化試驗方式或是實時老化試驗方法。加速老化試驗所得的有效期為試驗條件下推導得出,一定程度上代表了產品的壽命,但還需進行實時老化加以驗證。接觸鏡護理產品的有效期研究可參考標準YY0719.6進行。
接觸鏡護理產品的有效期研究應選取3批次樣品,若少于3批次應說明理由。試驗的典型性樣品應是最小規格包裝的型號,可以覆蓋容量大于最小規格8倍的樣品。
若采用加速老化試驗進行研究,則可以選取25±2℃為動力學溫度試驗均值,老化溫度應設置在45℃及以下。加速老化試驗推導產品有效期時至少還應提供3個月的實時老化試驗數據,并且不適用于預期超過2年的有效期。有效期的延長應通過實時老化試驗數據加以驗證。
接觸鏡護理產品有液態和固態之分,在進行有效期研究時濕度的選擇應根據產品劑型有所不同。一般對于固態產品應選擇相對濕度較高的條件(如75%±5%),而液態產品則更應考慮相對濕度較低的濕度條件(如≤40%)。試驗條件的選擇可參考下圖:
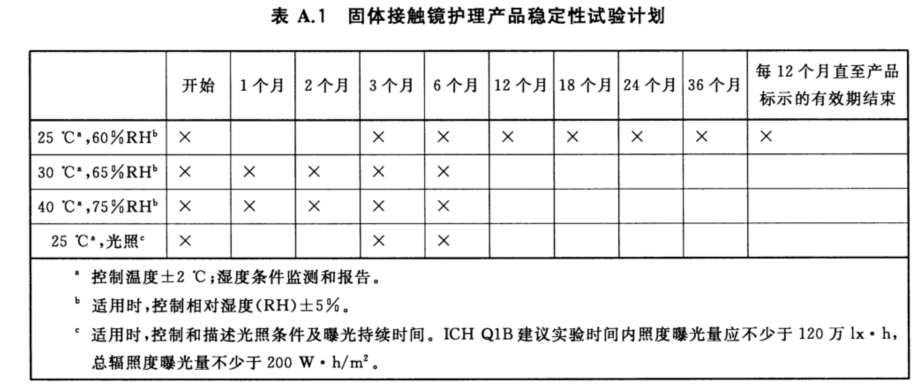
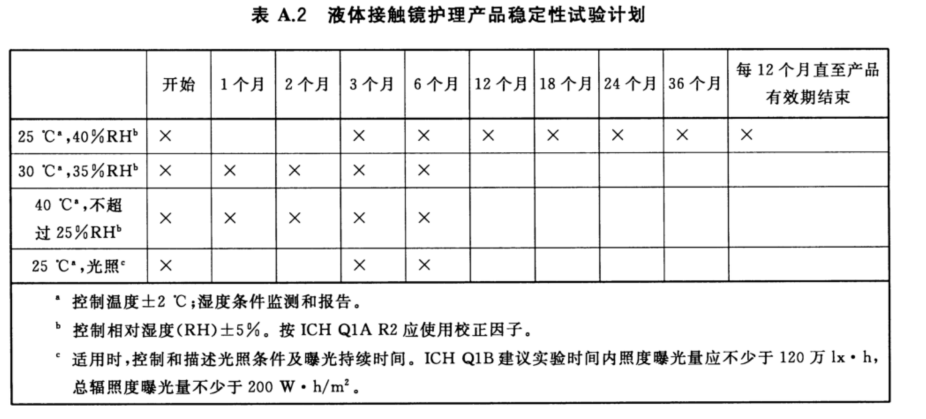
有效期研究時,性能測試的節點也可參考上圖選擇。測試時應對產品的物理性能(硬度、吸濕性或PH、澄清度、顏色等)、化學性能(特別是有效成分含量)、微生物性能(抗微生物活性、防腐有效性、微生物限量)。若無法通過化學方法確定穩定性,也可通過相關性能特性的試驗替代,但應說明試驗設計理由。
接觸鏡護理產品根據抗微生物活性的能力被區分為接觸鏡消毒護理產品和接觸鏡系統消毒護理產品。前者應當滿足直接殺菌試驗一類規范,后者應滿足直接殺菌試驗二類規范及模擬殺菌試驗要求。在進行抗微生物活性研究時應至少選取三批次樣品,如需進行模擬殺菌試驗還應考慮適用的鏡片種類,并根據YY 0719.3分配鏡片數量。
接觸鏡護理產品應驗證其在有效期內的防腐有效性和開瓶拋棄周期,應參考YY0719.4進行研究。接觸鏡護理產品的開瓶拋棄周期一般為28d,超過28d的可按照標準附錄的方法進行驗證。
接觸鏡護理產品的有效期研究耗時較長且在產品檢測時需要提交有效期研究報告,檢測機構需要對企業提供的有效期研究報告進行認可才能完成產品檢測,故而接觸鏡的有效期研究應及早安排。
