- GXP體系介紹 (含法規體系)
GCP:Good Clinical Practice |醫療器械臨床試驗質量管理規范
GMP:Good Manufacturing Practice |醫療器械生產質量管理規范
GSP:Good Supply Practice |醫療器械經營質量管理規范
GUP:Good Use Practice |醫療器械使用質量管理規范
- 醫療器械全生命周期GXP體系
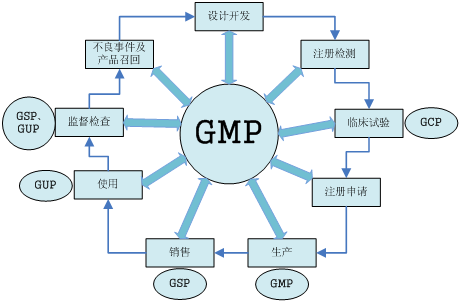

- GXP體系實施時間表
| 體系 | 名稱 | 執行時間 | 備注 |
| GCP | 醫療器械臨床試驗質量管理規范 | 征求意見中 | / |
| 醫療器械臨床評價技術指導原則 | 2014.09.11 | / | |
| 體外診斷試劑臨床試驗技術指導原則 | 2015.05.19 | / | |
| GMP | 醫療器械生產質量管理規范 | 2015.03.01 | 1. 2016.1.1:所有第三類醫療器械必須符合; 2. 2018.1.1:所有醫療器械及體外診斷試劑生產企業必須符合 |
| 醫療器械生產質量管理規范附錄無菌醫療器械 | 2015.10.01 | ||
| 醫療器械生產質量管理規范附錄植入性醫療器械 | 2015.10.01 | ||
| 醫療器械生產質量管理規范附錄體外診斷試劑 | 2015.10.01 | ||
| 醫療器械生產質量管理規范現場檢查指導原則 | 2015.09.25 | ||
| 醫療器械生產質量管理規范無菌醫療器械現場檢查指導原則 | 2015.09.25 | ||
| 醫療器械生產質量管理規范植入性醫療器械現場檢查指導原則 | 2015.09.25 | ||
| 醫療器械生產質量管理規范體外診斷試劑現場檢查指導原則 | 2015.09.25 | ||
| GSP | 醫療器械經營質量管理規范 | 2014.12.12 | / |
| 醫療器械經營質量管理規范現場檢查指導原則 | 2015.10.15 | / | |
| GSP | 醫療器械使用質量監督管理辦法 | 2016.02.01 | / |
- GXP體系監管方式
| GXP | 監管方式 | 監管主體 | 監管對象 |
| GCP | 現場核查、監督檢查、自查 | 藥監局 | 臨床試驗機構 |
| GMP | 現場核查、監督檢查、自查 | 藥監局 | 生產企業 |
| GSP | 現場核查、監督檢查、自查 | 藥監局 | 生產企業、經營企業 |
| GUP | 現場核查、監督檢查、自查 | 藥監局 | 醫療機構,如醫院、美容院、診所、衛生院 |
- 如何執行GXP體系
| GXP | 如何執行 |
| GCP | 取得《醫療機構執業許可證》和二級甲等以上資質的醫療機構可以根據《醫療器械臨床試驗機構資質認定管理辦法(征求意見)》的要求申請GCP資質 |
| GMP | 根據《醫療器械生產質量管理規范現場檢查指導原則》中的具體條款: 1.若不符合項目為“*”①項,則“未通過檢查”; 2.若不符合項雖僅有非“*”②項,但該項可能直接影響產品質量,則“未通過檢查”; 3.若不符合項僅有非“*”項,但該項不直接影響產品質量,則“整改后復查” |
| GSP | 根據《醫療器械經營質量管理規范現場檢查指導原則》中的具體條款: 1.若不符合項目為“※”①項,則“未通過檢查”; 2.若不符合項目雖為非“※”②項,不符合要求的項目數比例③>10%,則“未通過檢查” 3.若不符合項目僅為非“※”項,不符合要求的項目數比例≤10%,則“限期整改” |
| GUP | 醫療器械使用質量監督管理辦法中規定了采購、驗收、貯存、使用、維護與轉讓中的具體要求。 |
| 注 | ①:“*”項或“※”項 :關鍵項目; ②非“*”項或非“※”項:一般項目。 ③  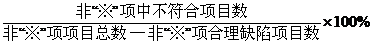 |
