為了論證產品對安全和性能基本原則的符合性,醫療器械產品注冊申報過程應當進行臨床評價。開展醫療器械臨床評價,可以根據產品特征、臨床風險、已有臨床數據等情形,通過開展臨床試驗,或者通過對同品種醫療器械臨床文獻資料、臨床數據進行分析評價,證明醫療器械的安全性、有效性。
對于如何選擇醫療器械臨床評價路徑,國家藥品監督管理局已陸續發布多項通用性指導原則,國家局醫療器械技術審評中心也發布了針對各子目錄產品的臨床評價推薦路徑(見附錄)。
本文主要介紹了醫療器械臨床評價路徑決策的分析思路,以便企業更好的通過非臨床試驗的方式完成臨床評價。
1. 什么下情況醫療器械產品需要進行臨床評價?
(1) 未列入《免于臨床評價醫療器械目錄》(國家局2021年第71號通告)的第二類、第三類醫療器械需要進行臨床評價。
(2) 列入《免于臨床評價醫療器械目錄》中,但是:
a. 醫療器械產品的適用范圍超過了免臨床評價目錄的描述內容;
b. 雖然符合免臨床評價目錄的描述內容,但是找不到同類產品;
c. 雖然符合免臨床評價目錄的描述內容,但是與同類產品的差異會影響產品的安全有效性,會出現同類產品不存在的且可能引發重大風險和/或引起顯著影響有效性的問題;
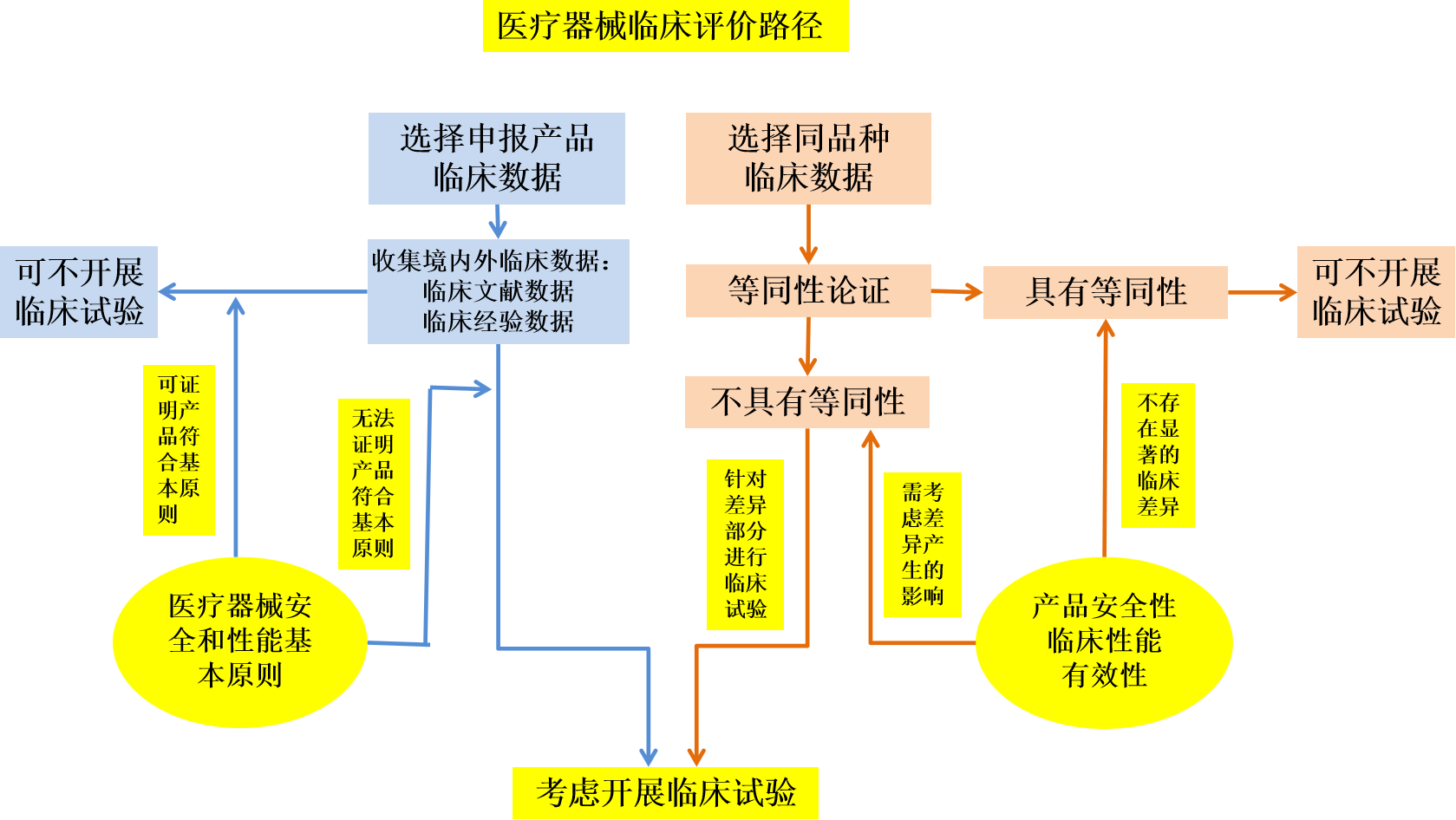
2.醫療器械臨床評價路徑
3.醫療器械臨床評價基本流程
(1) 識別需要臨床數據支持的安全和性能基本原則;
(2) 識別與產品及其適用范圍相關的可用的臨床數據;
(3) 根據產品在適用范圍下的安全性、臨床性能和/或有效性的論證需要,評價臨床數據的適宜性和貢獻;
(4) 在上述流程的基礎上,根據安全性、臨床性能和/或有效性剩余問題的解決需要,產生新的臨床數據;
(5) 匯總所有臨床數據,得出產品安全性、臨床性能和/或有效性的結論。
企業若對如何正確選擇臨床評價路徑、如何規避或降低臨床試驗要求等具體問題還有不理解的地方可參加瑞旭集團-北京西爾思聯合杭州天和高科技產業園有限公司在2022年10月28日舉辦的“醫療器械&體外診斷試劑臨床評價技術研討會”,歡迎各企業參會討論。
附錄 醫療器械臨床評價指導文件
|
發布年份 |
法規名稱 |
|
2018年 |
總局關于發布醫療器械臨床試驗設計指導原則的通告(2018年第6號) |
|
食品藥品監管總局關于發布接受醫療器械境外臨床試驗數據技術指導原則的通告(2018年第13號) |
|
|
2020年 |
國家藥監局關于發布真實世界數據用于醫療器械臨床評價技術指導原則(試行)的通告(2020年第77號) |
|
2021年 |
國家藥監局關于發布免于臨床評價醫療器械目錄的通告(2021年第71號) |
|
國家藥監局關于發布醫療器械臨床評價技術指導原則等5項技術指導原則的通告(2021年第73號) |
|
|
附件1 醫療器械臨床評價技術指導原則(國家局2021年第73號通告) |
|
|
附件2 決策是否開展醫療器械臨床試驗技術指導原則(國家局2021年第73號通告) |
|
|
附件3 醫療器械臨床評價等同性論證技術指導原則(國家局2021年第73號通告) |
|
|
附件4 醫療器械注冊申報臨床評價報告技術指導原則(國家局2021年第73號通告) |
|
|
附件5 列入免于臨床評價醫療器械目錄產品對比說明技術指導原則(國家局2021年第73號通告) |
|
|
2022年 |
關于發布《醫療器械分類目錄》子目錄11、12、13、14、15、17、22相關產品臨床評價推薦路徑的通告(2022年第20號) |
|
關于發布《醫療器械分類目錄》子目錄02、03、05、06、16、18、20相關產品臨床評價推薦路徑的通告(2022年第24號) |
|
|
關于發布《醫療器械分類目錄》子目錄01、04、07、08、09、10、19、21相關產品臨床評價推薦路徑的通告(2022年第30號) |
