2022年10月27日,國家藥品監督管理局醫療器械標準管理中心(NIFDC)對外發布《2022年第三次醫療器械分類界定結果匯總》在此次界定結果匯總中最值得關注的是,“注射用透明質酸鈉復合溶液”成分為透明質酸鈉和多聚脫氧核糖核苷酸(PDRN)復合溶液,用于注射至面部真皮層,從而改善皮膚狀態,為一次性使用無菌產品,被界定成以醫療器械為主的藥械組合產品。
目前在國內最受歡迎的三個再生材料為PLLA(童顏針)、PCL(少女針) PN/PDRN(嬰兒針)。PDRN。多聚脫氧核糖核苷酸(Polydeoxyribonudeotide),是一種可靠的細胞生長活性物質,是脫氧核糖核酸混合物,其二次進階版多核苷酸(PN)也逐步用于醫美類產品,與PLLA/PLC相比,PDRN/PN的抗衰效果更好,注射部位更廣。
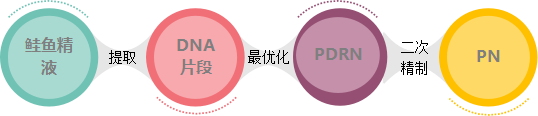
PDRN與PN二者都是從三文魚精囊細胞中提取優化的DNA片段,與人體DNA極為相似。具有刺激膠原蛋白和彈力纖維再生的功能,能有效緩解炎癥的功能,在人體皮膚、韌帶和肌腱的再生修復方面效果顯著。PDRN最早用于醫美是意大利Mastelli的嬰兒針,側重于抗炎修復。PN是初始PDRN的二次精制,側重于再生抗衰。
一、目前國內醫美注射產品分類
功能 | 成分及注射層次 | |
填充材料 | 擴張組織容積、 | 大分子透明質酸:真皮深層 |
填平褶皺、塑形 | 中分子透明質酸:真皮深層 | |
補水美膚 | 小分子透明質酸:真皮淺層和表皮 | |
補充材料 | 補充膠原 | 膠原蛋白:真皮層 |
刺激膠原再生 | PLLA、PCL、PN/PDRN:真皮深層、筋膜層、骨膜 | |
支撐材料 | 塑形、支撐輪廓,補充因骨質流失造成形態減損 | 骨性材料:真皮深層、皮下淺層、骨膜。 |
高交聯大分子透明質酸 | ||
CaHA(Radiesse)、PMMA(愛貝芙)、PVA(寶尼達)、葡聚糖等 | ||
埋線提拉:真皮深層、皮下脂肪、筋膜層、肌肉層 | ||
萎縮材料 | 減緩皺紋 | 肉毒素:肌肉組織 |
消溶組織 | 溶脂針:脂肪組織 | |
二、PLLA、PCL、PN/PDRN三者對比
| 童顏針 | 少女針 | 嬰兒針 |
成分 | PLLA聚左旋乳酸 | PCL微球+CMC凝膠 | PN/PDRN |
效果 | 填充,全面改善皮膚彈 性、皮膚失水 | “填充+修復”雙重功效 | 修復受損細胞,并達到多重護理功效 |
維持時間 及注射療程 | 1-2年(3-4次/療程,每次間隔4-6周) | 1-4年(需多次注射,不同產品型號不同) | 3-6個月(2-3次/療程, 每次間隔1-2個月) |
注射部位 | 用于面部(不適用眼瞼、嘴唇)、身體多部位 | 面部填充(不適合注射眼瞼、嘴唇等部位) | 全臉(眼周適用) |
注射層次 | 真皮深層以及皮下組織 層、骨膜上層 | 注射層次較深,有些涉及到筋膜層、骨膜層 | 真皮淺層、深層 |
三、PN與PDRN對比
| PDRN | PN |
批準適應癥 | 僅在處方上可用,不能作為非處方醫療設備提供;治療遲鈍的傷口和糖尿病足潰瘍。 | 僅作為非處方醫療器械提供 |
注射方式 | 肌肉內給藥 | 用于局部和皮內給藥 |
醫美類適應癥 | 抗炎:緩解肌膚炎癥,修復皮膚屏障 | 再生修復:激活皮膚再生力與修復力,長效PDRN。 |
分子量 | 350 | 1000 |
DNA長度 | 短 | 長 |
3D結構 | 無 | 有 |
四、PDRN&PN國內監管現狀
此產品目前在歐盟和韓國取得相應醫療器械注冊證,國內并無已批準的醫療器械注冊證。此類產品作為醫療美容類醫療器械風險較高,國內按照三類器械監管,因此需要符合醫療器械監管法規,獲得醫療器械注冊證和生產許可之后方可進行生產銷售。
品牌 | 國家 | 主要成分 | 持續時間 |
氐殊D+CELL | 韓國 | PDRN | 1-3個月 |
普麗蘭 | 韓國 | PDRN | 1-3個月 |
麗駐蘭 | 韓國 | PN | 1-3個月 |
麗鉑納 | 韓國 | PN | 1-3個月 |
露美嬰兒針 | 韓國 | PDRN | 1-3個月 |
Placentex | 意大利 | PDRN | 1-3個月 |
MASTELLINEWEST | 意大利 | PDRN | 1-3個月 |
Particolare鉑金 | 中國 | PDRN | 1-3個月 |
- | 歐盟 | PN:III 類 CE 0373 醫療器械 |
|
- | 中國 | PDRN與透明質酸鈉溶液混合界定為藥械組合以醫療器械為主的產品 |
|
(1)三類醫療器械注冊流程
依據《醫療器械監督管理條例》規定,第II、III類醫療器械施行注冊管理,在投放中國市場前,應先向藥品監督管理部門提交注冊申請并獲得醫療器械注冊證。同時確保在醫療器械生產質量管理規范體系下開展研發及生產經營活動。
(2)三類醫療器械臨床試驗
臨床試驗是醫療器械臨床評價過程中臨床數據的主要來源,是為評價醫療器械安全性、臨床性能或有效性而開展的系統性試驗或研究,包括可行性試驗、注冊臨床試驗及上市后臨床試驗。醫療器械臨床試驗應符合《醫療器械臨床試驗質量管理規范》(也稱為醫療器械GCP)要求,并在中國備案的醫療器械臨床研究機構開展。
了解更多關于醫美類醫療器械注冊及臨床試驗流程可直接聯系我們
北京: 010-6398 4062 杭州: 0571-8720 6527 郵箱:md@jianzaoshiwang.cn
五、參考法規
序號 | 成分 | 法規名稱 | 發布時間 |
1 | 透明質酸鈉 | 國家藥監局關于醫用透明質酸鈉產品管理類別的公告(2022年第103號) | 2022-11-14 |
《關于醫用透明質酸鈉產品管理類別的公告》(2022年第103號)解讀 | 2022-11-14 | ||
透明質酸鈉類面部注射填充材料臨床試驗指導原則(2019年第13號) | 2019-03-20 | ||
2 | 膠原蛋白 | 整形美容用重組人源化膠原蛋白注射材料技術審評要點(試行) | 2022-12-29 |
重組膠原蛋白創面敷料注冊審查指導原則(征求意見稿) | 2023-01-26 | ||
YY/T 1888-2023《重組人源化膠原蛋白》 | 2023-01-18 | ||
3 | PDRN | 《2022年第三次醫療器械分類界定結果匯總》 | 2022-10-27 |
4 | 藥械組合 | 以醫療器械作用為主的藥械組合產品注冊審查指導原則 | 2022-01-11 |
以醫療器械作用為主的藥械組合產品中藥物定性定量及體外釋放研究注冊審查指導原則 | 2022-02-26 |
六、藥監局已批準相關成分
序號 | 名稱 | 具體成分及預期用途 |
透明質酸鈉與羥丙基甲基纖維素復合的填充劑: | ||
1 | 醫用羥丙基甲基纖維素-透明質酸鈉溶液 | 由羥丙基甲基纖維素、透明質酸鈉和平衡鹽溶液組成的無菌凝膠狀溶液。用于皮膚真皮深層至皮下淺層之間注射填充,以糾正額部皺紋和中重度鼻唇部皺紋。 |
2 | 醫用透明質酸鈉-羥丙基甲基纖維素凝膠 | 主要由交聯透明質酸鈉顆粒、羥丙基甲基纖維素、磷酸鹽氯化鈉緩沖溶液及注射用水組成。用于皮膚皮下淺層至深層之間的填充,以糾正中重度額部皺紋和中重度鼻唇溝皺紋。 |
以可吸收聚酯類材料制成微球并填加輔料制成的填充劑: | ||
3 | 聚乳酸面部填充劑 | 該產品為聚乳酸微球、甘露醇和羧甲基纖維素鈉組成的凍干粉,使用前需經0.9%氯化鈉注射液復溶為混懸液。適用于注射到真皮深層,以糾正中重度鼻唇溝皺紋。 |
4 | 注射用聚己內酯微球面部填充劑 | 由人工合成的聚己內酯(PCL)微球、甘油、羥甲基纖維素、磷酸鹽緩沖溶液組成。用于皮下層植入,以糾正中到重度鼻唇溝皺紋。 |
5 | 含左旋乳酸-乙二醇共聚物微球的交聯透明質酸鈉凝膠 | 主要由交聯透明質酸鈉、左旋乳酸-乙二醇共聚物微球、鹽酸利多卡因、磷酸鹽緩沖體系組成。適用于真皮深層、皮下淺層及深層注射填充糾正中、重度鼻唇溝皺紋。 |
含不可降解成分的填充劑(即永久性填充劑): | ||
6 | 整形用膠原和PMMA皮下植入物系統 | 該產品為含聚甲基丙烯酸甲酯(PMMA)微球體的膠原蛋白懸浮液,含微量利多卡因。其中膠原蛋白來自澳大利亞的牛皮。裝量為0.1ml的規格為過敏測試用的測試針,成分為牛膠原蛋白溶液。用于注射到真皮深層以糾正鼻唇溝紋,或填充到骨膜外層以進行(鼻骨段)隆鼻。其中的PMMA為不可降解成分。 |
7 | 醫用含聚乙烯醇凝膠微球的透明質酸鈉-羥丙基甲基纖維素凝膠 | 主要由透明質酸鈉、羥丙基甲基纖維素、聚乙烯醇微球和平衡鹽溶液組成。用于皮膚真皮深層及皮下淺層之間注射填充,以糾正中重度額部皺紋和中重度鼻唇部皺紋。其中的聚乙烯醇為不可降解成分。 |
