某發膜產品抽檢不合格,既是委托生產方也是備案人的A和生產企業B雙雙受罰,由于貨值金額不同,A的罰金是B的3倍多,高達18萬元。
近日,廣州市白云區市場監督管理局公布的一則行政處罰決定書,引發行業關注,也讓從業者再次看到了當前化妝品抽樣檢驗的規范與嚴格。
巧合的是,就在幾天前,國家藥監局剛剛發布了2023年的第一個法規——《化妝品抽樣檢驗管理辦法》(以下稱《辦法》),針對化妝品抽驗的重點品類、抽樣場所、檢驗項目的方法等內容,再次進行了明確和重申。該法規自2023年3月1日起施行(詳情見:國家藥監局關于發布《化妝品抽樣檢驗管理辦法》的公告(2023年第5號) ) 。
有業內人士表示,未來不論是生產企業還是經營企業,監管、處罰都會沒有盲區。從此次處罰案例來看,行業顯然已經迎來了最嚴抽檢政策。
產品抽檢不合格
備案人“吃到”貨值金額5倍的罰單
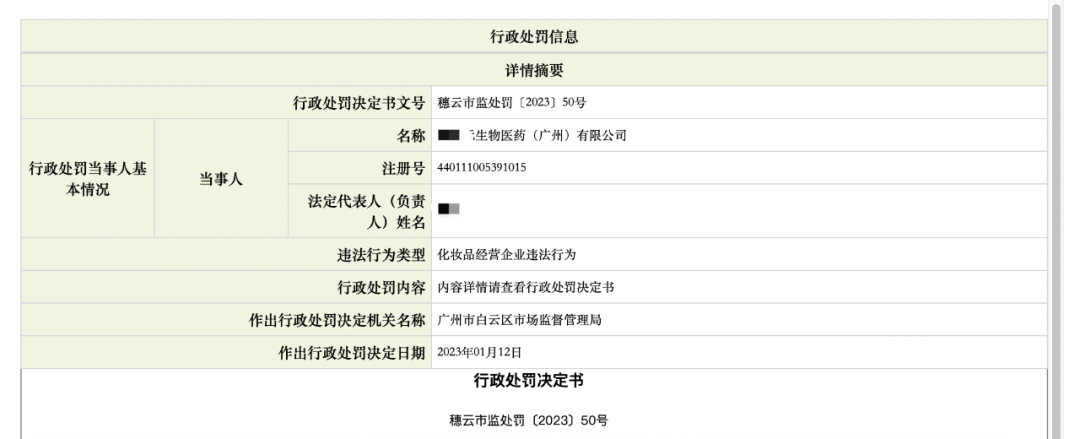
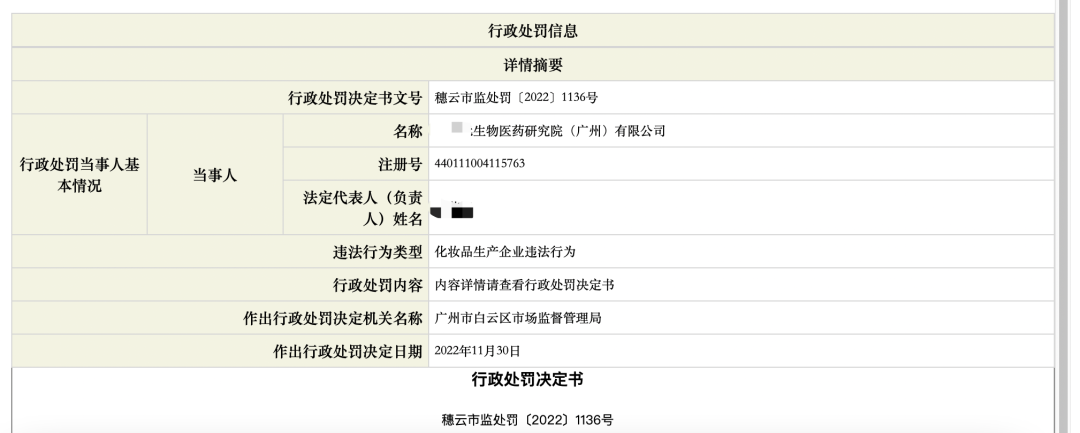
根據廣州市白云區市場監督管理局2023年01月12日和2022年11月30日分別出具的行政處罰決定書“穗云市監處罰〔2023〕50號”和“穗云市監處罰〔2022〕1136號”顯示,**生物醫藥(廣州)有限公司(下稱A)委托**生物醫藥研究院(廣州)有限公司(下稱B)生產某發膜產品,生產所需的原料及包裝材料由前者提供,因為產品抽檢不合格,委托生產企業和生產方均受了處罰。
圖片截自廣州市市場監督管理局
行政處罰決定書顯示,2022年3月6日,A委托B生產了該發膜產品共計3848支,其中B自檢消耗2支和留樣6支,A收取了成品3840支。按生產成本價格計算,B產品貨值金額為10039.3元。以8元每支的價格,A將該發膜產品全部銷售完畢,共獲得銷售收入30720元。
而經抽檢,該發膜產品甲基氯異噻唑啉酮和甲基異噻唑啉酮與氯化鎂及硝酸鎂的混合物(甲基氯異噻唑啉酮:甲基異噻唑啉酮為3:1)項目不符合規定,檢驗結論為不合格。且A與B對上述對抽檢結果無異議,且未在規定期限內申請復檢。
《化妝品監督管理條例》第六十條要求,“生產經營不符合強制性國家標準、技術規范或者不符合化妝品注冊、備案資料載明的技術要求的化妝品”,由負責藥品監督管理的部門沒收違法所得、違法生產經營的化妝品和專門用于違法生產經營的原料、包裝材料、工具、設備等物品;貨值金額1萬元以上的,并處貨值金額5倍以上20倍以下罰款。


圖片截自廣州市市場監督管理局
故,B收到的處罰為,沒收違法所得5772元;罰款50200元,罰沒款合計55972元。而A則被沒收違法所得30720元;罰款154000元,罰沒款合計184720元。
對于上述處罰案例,荃智美膚生物科技研究院研發總監張太軍指出,該產品由于防腐劑問題,導致抽檢結果不合格,說明生產企業沒有把好原料質量關,而委托方沒有督促好被委托方落實質量安全責任。“生產企業和委托生產方雙雙被罰,也意味著,不僅監管沒有盲區,處罰同樣沒有盲區。”
另一業內人士也指出,生產和經營方都需要對產品質量負責,其中,委托方應當向受托生產企業提供物料驗收標準,明確所提供原料成分、配比。
2023年首個新規落地
化妝品抽檢4大變化要關注
在這起處罰案例中,就在其中一份行政處罰決定書公開的當天(1月12日),針對化妝品抽樣檢驗的《辦法》也正式出爐。
事實上,早在2022年6月,國家藥品監督管理局就組織起草了《化妝品抽樣檢驗管理辦法(征求意見稿)》,向社會公開征求意見。儀美尚關注到,近日公布的《辦法》,對生產經營者義務;抽樣過程;檢驗和結果報送;異議和復檢等方面做出了重點調整。
首先,在總則中,《辦法》新增了生產經營者義務,強調化妝品生產經營者應當依法接受負責藥品監督管理的部門組織實施的化妝品抽樣檢驗,不得干擾、阻礙或者拒絕抽樣檢驗工作,不得提供虛假信息。
圖片截自國家藥品監督管理局
其次,化妝品抽樣檢驗重點關注產品除了兒童化妝品和特殊化妝品;使用新原料的化妝品,監督檢查、不良反應監測、安全風險監測、投訴舉報、輿情監測等監管工作中發現問題較多的;既往抽樣檢驗不合格率較高的;流通范圍廣、使用頻次高的;其他安全風險較高的產品,還新增了案件查辦中問題較多的產品。
第三,在抽樣過程中,《辦法》明確了現場抽樣產品來源,“現場抽樣的,抽樣人員應當從被抽樣化妝品生產經營者待銷售的產品中隨機抽取樣品,不得由被抽樣化妝品生產經營者自行選擇提供。”刪除了意見稿中,抽樣產品可以取自留樣產品的表述。

圖片截自《化妝品抽樣檢驗管理辦法》
當抽樣結果存在異常時,《辦法》也新增了處理規則,抽樣單位應當依法立案調查或者將問題線索依法通報具有管轄權的負責藥品監督管理的部門。而以下五種情況都屬于抽樣異常:一是,未經注冊的特殊化妝品或者未備案上市銷售、進口的普通化妝品;二是,產品超過使用期限;三是,無中文標簽;四是,標簽標注禁止標注的內容;五是,其他涉嫌違法的化妝品。除了第二項規定的情形外,對存在抽樣異常情況的產品,抽樣部門認為必要的,可以繼續抽樣。
值得一提的是,抽樣人員應當向化妝品注冊人、備案人、受托生產企業支付樣品費用,一般按照樣品的出廠價格支付;向化妝品經營者支付樣品費用,一般按照樣品的市場銷售價格支付。
第四,在檢驗和結果報送期間,檢驗機構“不得接受被抽樣化妝品生產經營者同一批次產品的委托檢驗”,而非意見稿中“不得接受被抽樣化妝品生產經營者相同產品的委托檢驗”。

圖片截自《化妝品抽樣檢驗管理辦法》
針對異議和復檢,《辦法》也做出了詳細的規定,化妝品注冊人、備案人、受托生產企業對樣品真實性有異議的,應當在收到檢驗報告等材料和抽樣檢驗結果告知書之日起7個工作日內,提出異議申請,并提交相關證明材料。而負責藥品監督管理的部門應當自受理異議申請之日起20個工作日內完成異議審查。
被抽樣產品的化妝品生產經營者對檢驗結論有異議,可以在收到檢驗報告等材料和抽樣檢驗結果告知書之日起7個工作日內,向實施抽樣檢驗的部門或者其上一級負責藥品監督管理的部門以書面形式提出復檢申請。同一樣品的復檢申請僅限一次。
此外,在信息公開方面,《辦法》明確,對不符合規定產品的信息公開應當至少包括:被抽樣產品名稱、包裝規格、生產日期或者批號、特殊化妝品注冊證編號或者普通化妝品備案編號、不符合規定的檢驗項目、標簽標示化妝品注冊人、備案人、受托生產企業、境內責任人名稱和地址、被抽樣化妝品生產經營者的名稱和地址、承檢機構名稱等。
“規范抽檢過程,能增加化妝品抽檢的公平性。”張太軍表示,“隨著《辦法》的發布,抽檢制度也在不斷更新、完善。而對于生產、經營企業來說,只有規范、如實經營,才能行穩致遠。”
相關推薦: