根據我國法規要求,注冊類保健食品所聲稱的保健功能應當已經列入保健食品功能目錄。目前,我國擬定的保健食品功能共有24個,企業需從允許聲稱的保健食品功能目錄中選擇與產品相匹配的功能。
為了進一步規范允許保健食品聲稱的保健功能目錄的管理工作,國家市場監督管理總局發布并實施了《保健食品原料目錄與保健功能目錄管理辦法》和《保健食品新功能及產品技術評價實施細則(試行)》,正式開放保健食品新功能的申報,推動保健食品新功能創新。
保健食品新功能的法規現狀
法規文件 | 實施日期 |
《保健食品原料目錄與保健功能目錄管理辦法》 | 2019年10月1日 |
《保健食品新功能及產品技術評價實施細則(試行)》 | 2023年8月28日 |
保健食品新功能建議人的資質要求
- 保健食品新功能建議人可為任何單位或者個人。
- 任何單位或者個人在開展相關研究的基礎上,可以單獨或聯合向國家市場監督管理總局食品審評中心提出新功能建議。
保健食品新功能的定位
保健食品新功能定位應當明確,分為以下三類:
1. 補充膳食營養物質
2. 維持或改善機體健康狀況
3. 降低疾病發生風險因素
保健食品新功能的申報流程
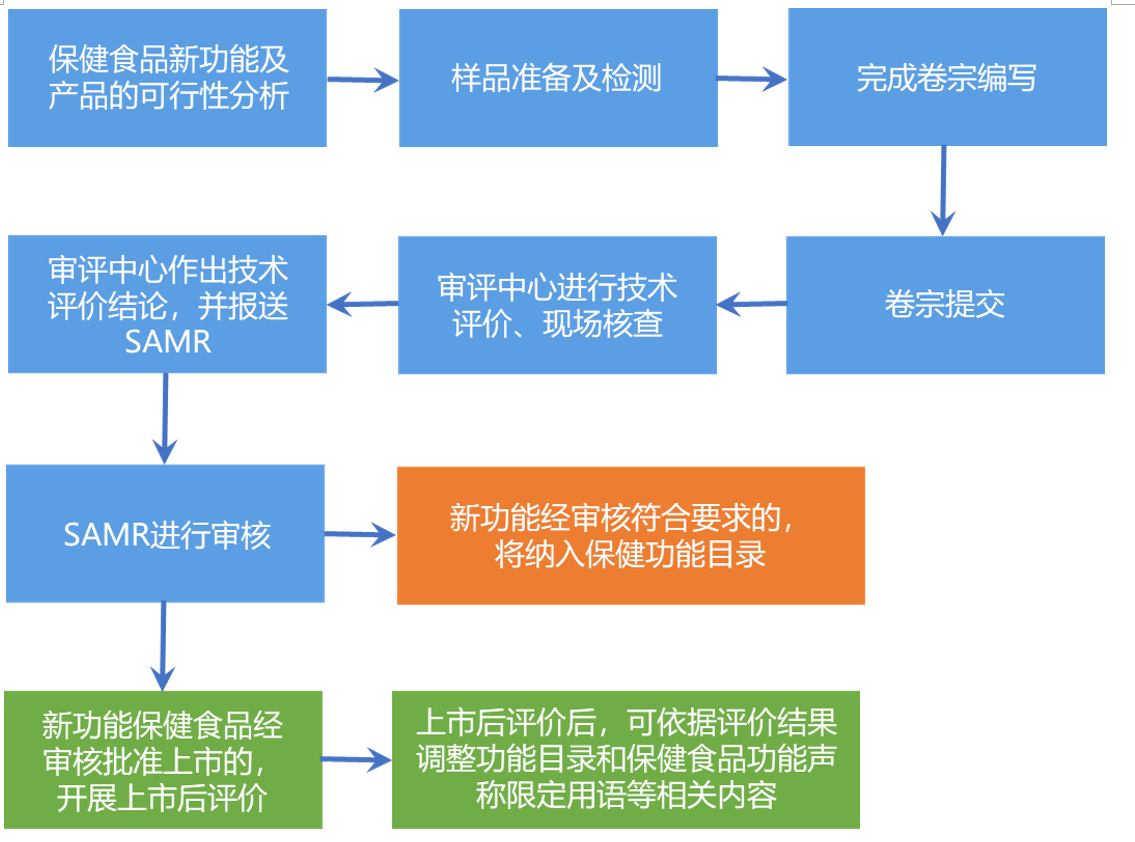
注:建議人同步提出新功能建議和對應的新功能保健食品注冊申請的,食品審評中心應當同步接收,開展關聯審評。
申報資料的要求
保健食品新功能的申報材料要求
建議人提交新功能建議時,應當按照《實施細則》附表“保健食品新功能建議材料項目要求和技術評價要點”提供技術評價材料,具體材料項目為:
1. 新功能建議材料目錄
2. 建議人對提交材料真實性負責的承諾書
3. 建議人身份證明或主體登記證明文件復印件
4. 保健功能名稱、解釋、機理及其依據
5. 保健功能研究報告
6. 保健功能評價方法及驗證評價資料
7. 相同或者類似保健功能在國內外的應用情況
8. 有助于技術評價的科學文獻依據及其他相關材料
9. 保健功能倫理學相關材料
10. 新功能研究樣品技術評價相關材料
11. 其他與功能建議和評價相關的材料
12. 其他人群試食試驗評價相關資料
13. 其他需要說明的問題
新功能保健食品的注冊申請材料要求
申請人提交新功能保健食品注冊申請時,應當按照保健食品注冊管理相關規定提交申請材料,申請人資質應當符合要求。
我們的服務
瑞旭其他熱門服務:
更多法規報告免費獲取:
- 免費獲取!2022年食品法規及行業熱點年度盤點報告 (點擊查看)
相關閱讀:
