一. 毒理實驗的定義及內容
毒理學實驗是指給實驗動物進行不同途徑、不同期限的染毒、檢測各種毒性終點的實驗。其目的是確定無害作用水平、毒性類型、靶器官、劑量-反應關系,為安全性評價或危險性評價提供重要的資料。
GB 15193.1-2014規定了食品安全性毒理學評價的程序。根據該標準,食品安全性毒理學評價試驗的內容包括:急性經口毒性試驗,遺傳毒性試驗,28天急性經口毒性試驗,90天急性經口毒性試驗,致畸試驗,生殖毒性試驗和生殖發育毒性試驗,毒物動力學試驗,慢性毒性試驗,致癌試驗,慢性毒性和致癌試驗合并試驗。
二. 申報前需要進行毒理實驗的食品種類
功能性保健食品(需注冊的類別),新食品原料,食品添加劑新品種,食品接觸材料添加劑和樹脂新品種。
三. 功能性保健食品(需注冊)的毒理實驗要求
由于《保健食品檢驗與評價技術規范(2003版)》已被廢止,本文關于保健食品毒理實驗的內容均來自于《保健食品毒理學評價程序(征求意見稿)》。
3.1保健食品的毒理試驗
- 受試物要求
樣品包裝 | 包裝完整的定型產品 注:由于推薦量較大等原因不適合以定型產品進行試驗時,可對送檢樣品適當處理(如濃縮,部分去除輔料)。需提供處理說明及相應證明文件。 |
樣品批次 | 與保健食品功能學試驗所用樣品批號一致,并且為衛生學試驗所用三批樣品之一(益生菌、奶制品等產品保質期短于整個試驗周期的產品除外)。 |
- 毒理試驗項目
- 一般應進行急性經口毒性試驗、三項遺傳毒性試驗和28天經口毒性試驗,根據實驗結果和目標人群確認是否需要進行其他試驗項目。
- 若保健食品為非傳統工藝生產且導致物質基礎發生重大改變,應進行急性經口毒性試驗、三項遺傳毒性試驗、90天經口毒性試驗和致畸試驗,必要時開展其他毒性試驗。
- 以普通食品、保健食品原料目錄內的物質為原料,僅采用物理粉碎或水提等傳統食品生產工藝生產、食用方法與傳統食用方法相同,且原料推薦食用量為常規用量或符合國家相關食品用量規定的保健食品,一般可不開展毒性試驗。
注:關于急性經口毒性試驗、三項遺傳毒性試驗和28天經口毒性試驗的解讀,請點擊“大比對:保健食品03版《檢驗與評價技術規范》VS《毒理學評價程序》”了解詳情。
3.2 保健食品新原料
當在注冊類保健食品中使用保健食品新原料時,除對產品的安全性評價外,還需對該新原料進行安全性評估。根據目前規定,保健食品新原料的安全性評估應參照新食品原料安全性審查的有關規定進行(新食品原料的毒理學試驗部分詳見下)。
四. 新食品原料的毒理實驗要求
- 新食品原料是指在我國無傳統食用習慣的以下物品:
- 動物、植物和微生物;
- 從動物、植物和微生物中分離的成分;
- 原有結構發生改變的食品成分;
- 其他新研制的食品原料;
- 新食品原料的毒理實驗項目
毒理學評價是新食品原料安全性評價中的重要內容,試驗項目主要由該原料在國內外有無傳統食用習慣情況和新食品原料的分類決定。
根據《新食品原料申報與受理規定》,原則上需要開展的毒理學試驗如下:
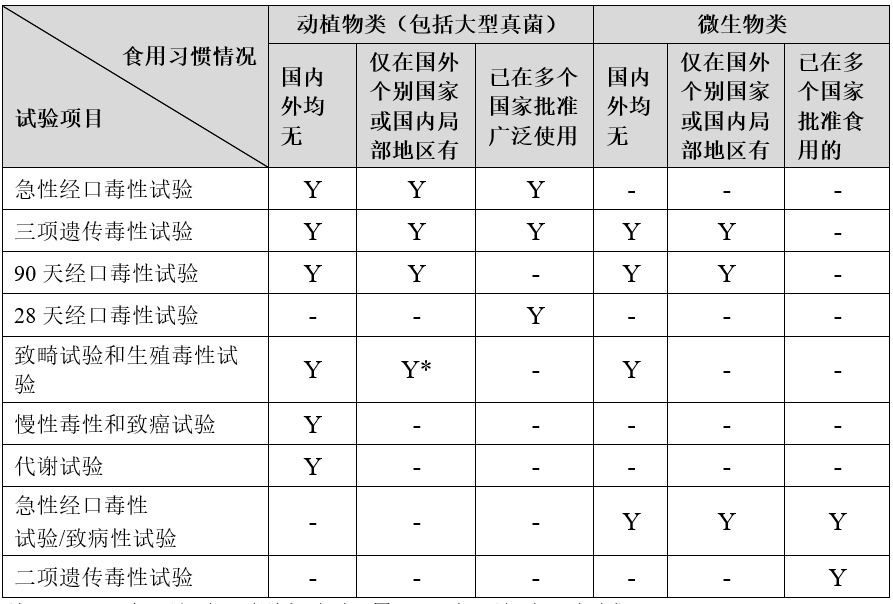
注:1)“Y”表示該項目原則上需要開展;“-”表示該項目不要求
2)*生殖毒性試驗一般不需要開展。
五. 食品添加劑新品種的毒理實驗要求
食品添加劑新品種的毒理試驗需要根據GB 15193.1-2014 食品安全性毒理學評價程序中的選擇原則開展。不同類型的食品添加劑新品種在毒理實驗項目上的要求不同:
- 香料
S.N. | 情況 | 毒理實驗要求 |
1 | 經WHO, FEMA,COE, IOFI中兩個或以上批準 | 一般不需要進行毒理實驗 |
2 | 僅一個國際組織批準 | 先進行急性經口毒性試驗、一項遺傳毒性試驗 |
3 | 未經國際組織允許使用 | 先進行急性經口毒性試驗、三項遺傳毒性試驗、28天經口毒性試驗 |
4 | 動植物可食部分提取的高單一純度天然香料,其化學結構及相關資料未提示有不安全的 | 一般不需要進行毒理實驗 |
- 酶制劑
S.N. | 情況 | 毒理試驗要求 |
1 | 長期具有安全食用歷史的動植物可食部分生產的酶制劑,且WHO已公布(或不需規定)日容許攝入量或被多個國家或組織批準 | 一般不要求進行毒理實驗 |
2 | 其他來源酶制劑,毒理資料完整,且WHO已公布(或不需規定)日容許攝入量或被多個國家或組織批準 |
|
3 | 其他來源酶制劑,一個國家批準使用,WHO未公布日容許攝入量或資料不完整 | 先進行急性經口毒性試驗、三項遺傳毒性試驗、28天經口毒性試驗 |
4 | 其他來源酶制劑,無國家批準使用 | 先進行急性經口毒性試驗、三項遺傳毒性試驗、90天經口毒性試驗和致畸試驗 |
- 其他食品添加劑(如乳化劑,著色劑,抗氧化劑等)
S.N. | 情況 | 毒理試驗要求 |
1 | 毒理學實驗完整, WHO已公布允許攝入量或被多個國家或組織批準的 |
|
2 | 只有一個國家批準,WHO未公布過允許攝入量或資料不完整 | 先進性急性經口毒性試驗,三項遺傳毒性試驗,28天經口毒性試驗和致畸試驗 |
3 | 若為動植物或微生物制取的單一組分、高純度添加劑,有一個國際組織或國家批準 | 急性經口毒性試驗、三項遺傳毒性試驗,28天經口毒性試驗 |
4 | 若為動植物或微生物制取的單一組分、高純度添加劑,無國際組織或國家批準 | 先進性急性經口毒性試驗,三項遺傳毒性試驗,90天經口毒性試驗和致畸試驗 |
六. 食品接觸材料新物質(添加劑、樹脂)的毒理實驗要求
根據《食品相關產品新品種申報與受理規定》,食品接觸材料新物質的毒理實驗需依據產品的遷移量實驗結果確定。物質遷移量越低,需要提供的毒理學試驗報告越簡單。
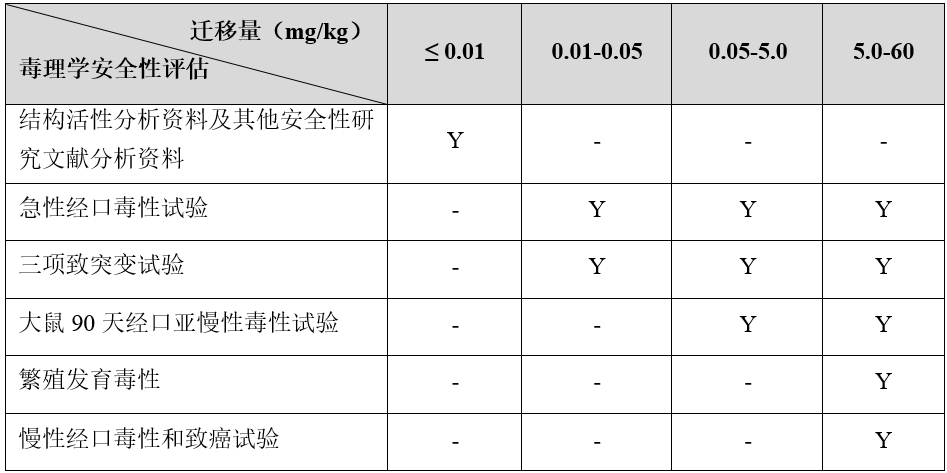
注. 1. “Y”表示該項目原則上需要開展;“-”表示該項目不要求;
2. 高分子聚合物(平均分子量大于1000道爾頓)應當提供各單體的毒理學安全性評估資料;
七. 毒理學報告出具實驗室要求
產品類別 | 實驗室要求 | 試驗方法 | |
1 | 功能性保健食品(需注冊的) | 國內有食品檢驗資質并在SAMR備案過的實驗室 | 《保健食品毒理學評價程序》(正式版本還未發布) |
2 | 新食品原料 |
| GB 15193系列毒理實驗標準。若在國外GLP實驗室進行,試驗方法未規定。 |
3 | 食品添加劑新品種 | ||
4 | 食品接觸材料添加劑和樹脂新品種 |
結語
食品安全毒理學試驗是評價食品及食品原料安全性的重要手段。通常情況下,一個新產品或一個新物質的毒理試驗需要花費數月甚至一年以上的時間,費用從幾萬到幾十萬不等。因此,了解不同物質申報時的毒理試驗要求,選擇合理的毒理試驗項目對于節約申報時間和成本有著重要作用。在開展相關新產品和新物質的申報前,申請人應當對此進行充分評估。
我們的服務:
