英文名稱:Guideline on the Inspection and Evaluation of Physicochemical and Hygienic Indicators of Health Food (2020)
發布時間:2020/10/31
實施時間:2020/10/31
發布單位:國家市場監督管理總局
国产精品无码不卡视频丨国产精品青草久久久久影视福利丨无码专区男人本色丨成人无码小视频在线观看丨水蜜桃美女啪啪视频丨精品毛片一区二区三区丨99re视频在线只有精品丨日韩欧美精品有码在线 保健食品理化及衛生指標檢驗與評價技術指導原則(2020年版)
目 錄
第一部分 總則
一、主題內容和適用范圍
二、基本要求
第二部分 功效成分/標志性成分檢驗方法
一、保健食品中紅景天苷和酪醇的測定
二、保健食品中大蒜素的測定
三、保健食品中蘆薈苷的測定
四、保健食品中左旋肉堿的測定
五、保健食品中α-亞麻酸、γ-亞麻酸的測定
六、保健食品中人參皂苷的測定
七、保健食品中前花青素的測定
八、保健食品中核苷酸的測定
九、保健食品中洛伐他汀的測定
十、保健食品中槲皮素、山柰素、異鼠李素的測定
十一、保健食品中茶氨酸的測定
十二、保健食品中五味子醇甲、五味子甲素和乙素的測定
十三、保健食品中腺苷的測定
十四、保健食品中總皂苷的測定
十五、保健食品中總黃酮的測定
十六、保健食品中殼聚糖脫乙酰度的測定
十七、保健食品中總蒽醌的測定
十八、保健食品中10-羥基-2-癸烯酸的測定
十九、保健食品中絞股藍皂苷XL IX的測定
二十、保健食品中總三萜的測定
二十一、保健食品中蟲草素的測定
二十二、保健食品中D-甘露醇的測定
二十三、保健食品中功效成分/標志性成分食品安全國家標準檢測方法
第三部分 溶劑殘留的測定
第四部分 違禁成分的測定
一、主題內容和適用范圍
1.本指導原則規定了保健食品及其原料、輔料理化及衛生指標檢驗與評價的基本要求、功效成分/標志性成分檢驗方法、溶劑殘留和違禁成分的測定要求。
2.本指導原則適用于保健食品的注冊和備案檢驗。
二、基本要求
1. 保健食品應符合《食品安全國家標準 保健食品》(GB 16740)的各項要求和檢驗方法規定。對于不同配方、不同形態、不同工藝的產品,申請人應同時制定符合要求的理化、功效成分/標志性成分、微生物等指標對產品質量進行有效控制。
2. 直接接觸保健食品的包裝材料應符合相應食品安全國家標準及相關規定。
3. 普通食品形態產品應檢測并制定凈含量及允許負偏差指標,指標應符合《定量包裝商品凈含量計量檢驗規則》(JJF 1070)規定。膠囊等非普通食品形態產品應制定裝量或重量差異指標。裝量或凈含量只檢測內容物,不包括隔離材料。
4. 最小服用單元含有惰性隔離材料填充的產品,如膠囊,其功效成分或者指標成分、農藥殘留、灰分、水分等指標以去除隔離材料(膠囊殼)的內容物為檢測單元,對于非法添加藥物、重金屬、鉻、色素(如材料帶顏色)等則需要進行整體檢測,或者檢測結果明確標識相關檢測部位。
5. 本指導原則第二部分提供的檢測方法為推薦方法,注冊申請人在對產品進行功效成分/標志性成分檢測時,應選擇適合相應產品的檢測方法。申請注冊檢驗時,應提供該產品的配方、工藝、產品技術要求及功效成分/標志性成分檢測方法以及檢測方法的適用性、重現性等方法學研究材料。檢測方法應科學、適用、重現。注冊檢驗機構對所附材料進行審核,必要時進行有關驗證和方法確認,如申報單位提供的方法不適合送檢的樣品時,注冊檢驗機構不得擅自修改,應將有關情況反饋申報單位,由其進行研究并提供方法后,再對送檢樣品進行試驗,確保試驗方法與送檢產品技術要求中規定的方法一致。復核檢驗機構應按照申報單位提交的檢驗方法進行檢驗并出具復核檢驗報告。
6. 注冊申請人應當自行開展或委托具備法定資質的注冊檢驗機構,按照國家相關規定和標準等要求,根據樣品具體情況,合理地進行穩定性試驗設計和研究。通過穩定性試驗,考察樣品在不同環境條件下(如溫度、相對濕度等)的化學、物理及生物學特征隨時間增加其變化程度和規律,從而判斷樣品包裝、貯存條件和保質期內的穩定性。產品穩定性重點考察指標,主要包括感官、微生物、崩解時限(溶散時限、溶化性等)、水分、pH值、酸價、過氧化值、列入理化指標中的特征成分等隨儲存條件和儲存時間容易發生變化的指標。產品非穩定性重點考察指標,主要包括鑒別、灰分、污染物(如鉛、總砷、總汞等)、真菌毒素、農殘(如六六六、滴滴涕等)、國家相關標準及現行規定有用量限制的合成色素和甜味劑等隨儲存條件和儲存時間不易發生變化的指標,以及國家相關標準及現行規定有用量限制的抗氧化劑指標。
穩定性試驗為注冊申請人自行開展的,組織實施的檢驗質量控制、報告編制、樣品和檔案管理等工作以及出具的報告格式內容,應當符合有關規定。穩定性試驗為注冊申請人委托檢驗的,被委托單位應當為具有法定資質的食品檢驗機構。
7. 標準規定不得檢出的項目結果,檢測結果在方法定量限以上時,按照具體檢出值報送結果;檢測結果在方法檢出限以下時,注明“未檢出,檢出限值”;檢測結果在方法檢出限以上、定量限以下時,注明“檢出且小于定量限,定量限值,檢出限值”。
8. 保健食品中原料和輔料應符合保健食品原輔料質量要求的有關規定,有適用的國家相關標準、地方標準、行業標準等的,其質量應符合相關規定。原輔料質量要求內容有缺項難以或無需制定的,應說明原因。原料若為植物提取物或者原料及輔料加工過程中使用、間接引入有機溶劑時,涉及的有機溶劑應符合《食品安全國家標準 食品添加劑使用標準》(GB 2760)附錄C中食品工業用加工助劑使用名單規定,或有關規定。企業可根據產品質量控制需要,采用本指導原則中第三部分溶劑殘留的測定方法將溶劑殘留檢測列入原料或產品的技術要求。
9. 違禁成分的檢測作為相應保健功能類別產品的功能試驗樣品注冊檢驗要求,應當符合本指導原則第四部分的規定。
第二部分
功效成分/標志性成分檢驗方法
一、保健食品中紅景天苷和酪醇的測定
1 范圍
本方法規定了以紅景天為主要原料的保健食品中紅景天苷和酪醇的液相色譜測定方法。
本方法適用于保健食品中紅景天苷和酪醇的測定。
2 原理
試樣經甲醇超聲提取,以0.01mol/L乙酸銨-甲醇為流動相(80+20),采用高效液相色譜法,紫外檢測器檢測,根據保留時間定性,外標法定量。
3 試劑和材料
注:除非另有說明,本方法所用試劑均為分析純,水為GB/T 6682規定的一級水。
3.1 試劑
3.1.1 乙酸銨(CH3COONH4)。
3.1.2 甲醇(CH3OH):色譜純。
3.1.3 甲醇(CH3OH)。
3.2 標準品
紅景天苷、酪醇標準樣品的分子式、相對分子量、CAS登錄號見表1,純度≥98%,或經國家認證并授予標準物質證書的標準物質。
表1 紅景天苷、酪醇標準樣品的中文名稱、英文名稱、CAS登錄號、分子式、相對分子量
|
中文名稱 |
英文名稱 |
CAS登錄號 |
分子式 |
相對分子量 |
|
紅景天苷 |
Salidroside |
10338-51-9 |
C14H20O7 |
300.30 |
|
酪醇 |
Tyrosol |
501-94-0 |
C8H10O2 |
138.16 |
3.3.1 紅景天苷標準儲備液(2.0mg/mL):準確稱取紅景天苷標準品20mg(精確至0.01mg)于10mL容量瓶中,用甲醇(3.1.2)溶解并定容至刻度,搖勻。
3.3.2 紅景天苷標準工作液:將紅景天苷標準儲備液(3.3.1)用甲醇(3.1.2)稀釋制備一系列標準溶液,標準系列濃度為0.00mg/mL、0.01mg/mL、0.02mg/mL、0.05mg/mL、0.20mg/mL、0.50mg/mL,臨用時配制。
3.3.3 酪醇標準儲備液(2.0mg/mL):準確稱取酪醇標準品20mg(精確至0.01mg)于10mL容量瓶中,用甲醇(3.1.2)溶解并定容至刻度,搖勻。
3.3.4 酪醇標準工作液:將酪醇標準儲備液(3.3.3)用甲醇(3.1.2)稀釋制備一系列標準溶液,標準系列濃度為0.00mg/mL、0.01mg/mL、0.02mg/mL、0.05mg/mL、0.10mg/mL、0.20mg/mL,臨用時配制。
3.3.5 系統適用性溶液:量取紅景天苷標準儲備液(3.3.1)和酪醇標準儲備液(3.3.3)各0.5mL于10mL容量瓶中,用甲醇(3.1.2)稀釋至刻度,搖勻。
3.4 試劑配制
乙酸銨溶液(0.01mol/L):稱取0.77g乙酸銨,加入適量水溶解并定容至1000mL,經0.45μm濾膜(3.5.1)過濾后備用。
3.5 材料
3.5.1 水相微孔濾膜:0.45µm。
3.5.2 有機相微孔濾膜:0.45µm。
4 儀器和設備
4.1 高效液相色譜儀:配有紫外檢測器(UV)。
4.2 超聲波清洗器。
4.3 分析天平:感量為0.01mg和0.0001g。
5 分析步驟
5.1 試樣制備
5.1.1 固體樣品:準確稱取已粉碎混合均勻的固體待測試樣適量(約含紅景天苷5mg)于 25mL容量瓶中,加入甲醇(3.1.3)約20mL,超聲提取30min,放冷至室溫,用甲醇(3.1.3)定容至刻度。混勻后經0.45μm濾膜(3.5.2)過濾,供液相色譜分析用。
5.1.2 液體樣品:準確吸取搖勻后的待測試樣適量(約含紅景天苷5mg),置于蒸發皿內,水浴蒸干,用甲醇溶解并(3.1.3)轉移至25mL容量瓶中并定容至刻度。混勻后經0.45μm濾膜(3.5.2)過濾,供液相色譜分析用。
5.2 儀器參考條件
5.2.1 色譜柱:C18柱, 250mm×4.6mm, 5μm,或同等性能色譜柱;
5.2.2 流動相:乙酸銨溶液(0.01mol/L)-甲醇(80+20);
5.2.3 流速:1.0mL/min;
5.2.4 柱溫:25℃;
5.2.5 檢測波長:215nm;
5.2.6 進樣量:10L。
5.2.7 系統適用性試驗:取系統適用性溶液(3.3.5)10L,注入液相色譜儀,記錄色譜圖,紅景天苷峰與酪醇峰的分離度應大于1.5。
5.3 標準曲線的制作
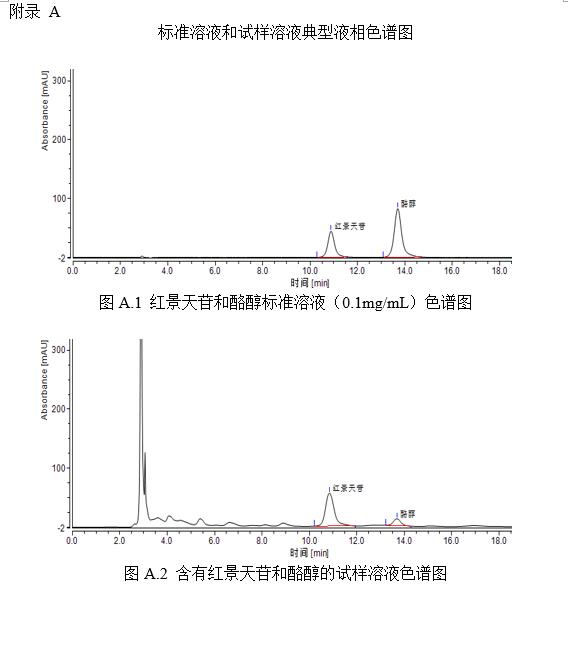
將紅景天苷標準系列工作液(3.3.2)或酪醇標準系列工作液(3.3.4)分別注入高效液相色譜儀中,測定相應的色譜峰高或峰面積,以標準工作液的濃度為橫坐標,以峰面積或峰高為縱坐標,繪制標準曲線(標準溶液液相色譜圖見附錄A中圖A.1)。
5.4 試樣溶液的測定
將試樣待測液(5.1.1或5.1.2)注入液相色譜儀中,以保留時間定性,測得峰面積或峰高,根據標準曲線得到待測液紅景天苷或酪醇的濃度(樣品溶液液相色譜圖見附錄A中圖A.2)。
6 結果計算
試樣中紅景天苷或酪醇含量按下式計算:
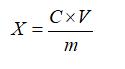
X—試樣中紅景天苷或酪醇的含量,單位為毫克每克或毫克每毫升(mg/g或mg/mL);
C—由標準曲線查得待測樣液中紅景天苷或酪醇的濃度,單位為毫克每毫升(mg/mL);
V—樣品的定容體積,單位為毫升(mL);
m—樣品量,單位為克或毫升(g或mL)。
計算結果以重復性條件下獲得的兩次獨立測定結果的算術平均值表示,保留兩位有效數字。
7 精密度
在重復性條件下獲得的兩次獨立測定結果的絕對差值不得超過算術平均值的10%。
二、保健食品中大蒜素的測定
1 范圍
本方法規定了保健食品中大蒜素(二烯丙基三硫化物)的測定方法。
本方法適用于以大蒜及其加工品為主要原料制成的保健食品中大蒜素(二烯丙基三硫化物)的測定。
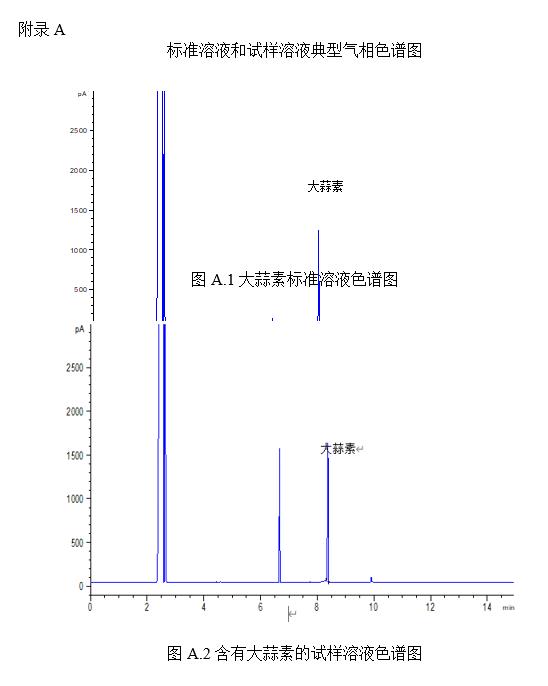
試樣經有機溶劑提取,通過氣相色譜檢測,以保留時間定性,外標法定量。
注:除非另有說明,本方法所用試劑均為分析純。
3.1 試劑
3.1.1 無水乙醇(C2H5OH)。
3.1.2 正己烷(CH3(CH2)4CH3)。
3.1.3 無水硫酸鈉(Na2SO4)。
3.2 標準品
大蒜素標準樣品的分子式、相對分子量、CAS登錄號見表1,純度≥99.0%,或經國家認證并授予標準物質證書的標準物質。
表1 大蒜素標準樣品的中文名稱、英文名稱、CAS登錄號、分子式、相對分子量
|
中文名稱 |
英文名稱 |
CAS登錄號 |
分子式 |
相對分子量 |
|
大蒜素 |
Allitride |
2050-87-5 |
C6H10S3 |
178.33 |
3.3 標準溶液配制
3.3.1 大蒜素標準儲備液(5.0mg/mL):稱取125.0mg大蒜素于25mL容量瓶中,用正己烷(3.1.2)定容至刻度,搖勻。此溶液可在4℃冰箱中保存七天。
3.3.2 大蒜素標準工作液:分別準確吸取不同體積的標準儲備液(3.3.1),用正己烷(3.1.2)將其稀釋成大蒜素含量分別為0.1mg/mL、0.5mg/mL、1.0mg/mL、1.5mg/mL、2.0mg/mL的標準系列工作溶液,臨用配制。
3.4 材料
微孔濾膜:0.45µm,有機相。
4.1 氣相色譜儀:配有氫火焰離子化檢測器(FID)。
4.2 分析天平:感量為0.01mg和0.0001g。
4.3 超聲清洗器。
5.1 試樣制備
5.1.1 固體試樣
稱取已粉碎混合均勻的固體待測試樣適量(含待測組分約5mg,精確到0.0001g)于5mL容量瓶中,加無水乙醇2.5mL,密塞,超聲(功率800W,頻率40kHz)提取20min,取出冷卻至室溫,加正己烷定容,搖勻,過0.45μm微孔濾膜過濾,待上機測試用。
5.1.2 油狀試樣
稱取已混合均勻的油狀待測試樣適量(含待測組分約5mg,精確到0.0001g)于5mL容量瓶中,加正己烷溶解并定容,搖勻,過0.45μm微孔濾膜過濾,待上機測試用。
5.1.3 含水液體試樣
精密吸取已混合均勻的待測試樣適量(含待測組分約10mg),置于分液漏斗中,加4mL正己烷振搖提取1min,靜置分層,取上層清液過無水硫酸鈉,提取兩次。用適量正己烷沖洗無水硫酸鈉,合并至同一10mL容量瓶中,用正己烷定容至刻度,搖勻。過0.45μm微孔濾膜過濾,待上機測試用。
5.2 儀器參考條件
5.2.1 色譜柱:(5%-苯基)-甲基聚硅氧烷固定相,柱長30m,內徑0.25mm,膜厚0.25μm或其他同等性能色譜柱。
5.2.2 柱溫箱溫度:起始溫度100℃保持3min,10℃/min速度升至150℃,再以20℃/min速度升至200℃,保持20min。
5.2.3 進樣口溫度:220℃。
5.2.4 檢測器溫度:250℃。
5.2.5 載氣:高純氮氣,流量1.0mL/min。
5.2.6 氫氣:40mL/min;空氣:400mL/min。
5.2.7 進樣量:1μL。
5.3 測定
將1μL的標準工作溶液(3.3.2)和試樣溶液(5.1)注入氣相色譜儀中,以保留時間定性,測得峰面積或峰高,外標法定量。
標準工作溶液圖譜及試樣溶液圖譜見附錄A。
試樣中大蒜素含量按下式計算:
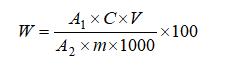
式中:
W—大蒜素的含量,單位為克每百克或克每百毫升(g/100g或g/100mL);
A1—試樣溶液色譜峰面積或峰高;
A2—標準工作液峰面積或峰高;
C—標準工作液濃度,單位為毫克每毫升(mg/mL);
V—試樣定容體積,單位為毫升(mL);
m—試樣的質量或體積,單位為克或毫升(g或mL);
100—單位轉換;
1000—單位轉換。
計算結果以重復性條件下獲得的兩次獨立測定結果的算術平均值表示,保留三位有效數字。
在重復性條件下獲得的兩次獨立測定結果的絕對差值不得超過算術平均值的10%。
三、保健食品中蘆薈苷的測定
1 范圍
本方法規定了保健食品中蘆薈苷含量的高效液相色譜測定方法。
本方法適用于以蘆薈及其加工品為主要原料的保健食品中蘆薈苷含量的測定。
2 原理
樣品用甲醇+水(55+45)作為溶劑,提取試樣中的蘆薈苷,經C18柱分離,在293nm波長處檢測,以蘆薈苷保留時間定性,峰面積外標法定量。
3 試劑和材料
注:除非另有說明,本方法所用試劑均為分析純,水為GB/T 6682規定的一級水。
3.1 試劑
3.1.1 甲醇(CH3OH):色譜純。
3.1.2 石油醚:沸程30℃~60℃。
3.2 標準品
蘆薈苷標準樣品的分子式、相對分子量、CAS登錄號見表1,純度≥90%,或經國家認證并授予標準物質證書的標準物質。
表1 蘆薈苷標準樣品的中文名稱、英文名稱、CAS登錄號、分子式、相對分子量
|
中文名稱 |
英文名稱 |
CAS 登錄號 |
分子式 |
相對分子量 |
|
蘆薈苷 |
Aloin |
1415-73-2 |
C21H22O9 |
418.39 |
3.3 標準溶液配制
3.3.1 蘆薈苷標準儲備液:稱取蘆薈苷標準樣品(3.2)10mg(精確至0.01mg)于25mL容量瓶中,加流動相溶解并定容至刻度,搖勻,此溶液濃度為0.4mg/mL。臨用新配。
3.3.2 蘆薈苷標準系列工作液:分別準確吸取蘆薈苷標準儲備液(3.3.1)0.5mL、1.0mL、2.0mL、4.0mL、6.0mL至10mL容量瓶中,用流動相定容,得濃度為0.02mg/mL、0.04mg/mL、0.08mg/mL、0.16mg/mL、0.24mg/mL的標準系列工作液。
3.4 微孔濾膜:0.45µm,有機相。
4 儀器和設備
4.1 高效液相色譜儀:配有二極管陣列檢測器或紫外檢測器。
4.2 超聲波清洗器。
4.3 分析天平:感量分別為0.01mg和0.001g。
4.4 離心機:轉速≥3000r/min。
5 分析步驟
5.1 試樣制備
5.1.1 固體試樣
稱取已粉碎混合均勻的待測試樣適量(約含蘆薈苷4mg,精確到0.001g),置具塞錐形瓶中,加入50.0mL流動相(5.2.2),稱重,超聲處理20min,放冷,用流動相補足減失的重量,搖勻,經微孔濾膜(3.4)過濾,濾液待測。必要時可進行適當稀釋。
5.1.2 含油基質試樣
稱取已粉碎混合均勻的待測試樣適量(約含蘆薈苷4mg,精確到0.001g),置具塞錐形瓶中,加入25.0mL石油醚(3.1.2),渦旋使充分混勻,過濾,棄去石油醚液,再用少量石油醚洗滌錐形瓶及濾紙,揮干,將濾紙和殘渣置于原具塞錐形瓶中,加入50.0mL流動相(5.2.2),稱重,超聲處理20min,放冷,用流動相補足減失的重量,搖勻,經微孔濾膜(3.4)過濾,濾液待測。必要時可進行適當稀釋。
5.1.3 水性液體試樣
吸取待測試樣,必要時以流動相(5.2.2)適當稀釋,離心,取上清液經微孔濾膜(3.4)過濾。
5.2 儀器參考條件
5.2.1 色譜柱:C18柱, 250mm×4.6mm,5μm,或性能相當者。
5.2.2 流動相:甲醇(3.1.1)+水,(55+45,v/v)。
5.2.3 流速:1.0mL/min。
5.2.4 柱溫:40℃。
5.2.5 檢測波長:293nm。
5.2.6 進樣量:10μL。
5.3 標準曲線的制作
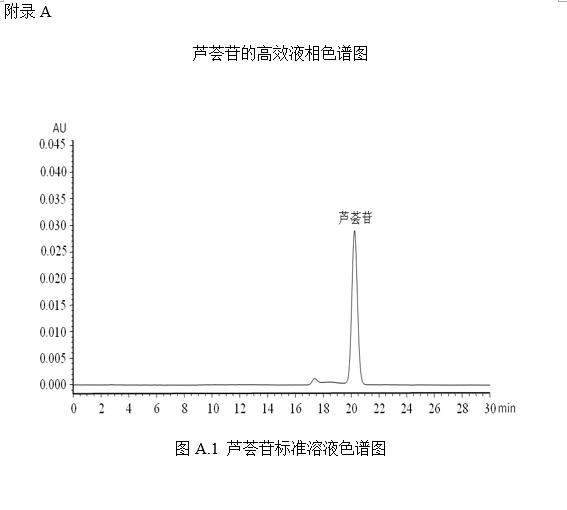
將標準系列工作液(3.3.2)分別按液相色譜參考條件(5.2)進行測定,得到相應的蘆薈苷標準溶液的色譜峰面積,以標準工作液的濃度為橫坐標,以色譜峰的峰面積為縱坐標,繪制標準曲線。
5.4 試樣溶液的測定
將試樣溶液(5.1)按液相色譜參考條件(5.2)進行測定,得到相應的樣品溶液蘆薈苷的色譜峰面積,根據標準曲線得到待測液中蘆薈苷的濃度,平行測定次數不少于兩次。
蘆薈苷的標準液相色譜圖參見附錄A的圖A.1。
6 結果計算
試樣中蘆薈苷含量按下式計算:
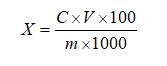
式中:
X—試樣中蘆薈苷的含量,單位為克每百克(g/100g)或克每百毫升(g/100mL);
C—由標準曲線得出的樣液中蘆薈苷的濃度,單位為毫克每毫升(mg/mL);
V—試樣的最終定容體積,單位為毫升(mL);
m—試樣取樣量,單位為克(g)或毫升(mL);
100—單位轉換;
1000—單位轉換。
計算結果以重復性條件下獲得的兩次獨立測定結果的算術平均值表示,保留三位有效數字。
7 精密度
在重復性條件下獲得的兩次獨立測定結果的絕對差值不得超過算術平均值的10%。
四、保健食品中左旋肉堿的測定
1 范圍
本方法規定了保健食品中左旋肉堿的液相色譜測定方法。
本方法適用于以左旋肉堿為主要原料的保健食品中肉堿的含量測定。
2 原理
試樣中的左旋肉堿以0.50mmol/L的鹽酸溶液經超聲提取,反相色譜分離,以保留時間定性,外標法定量。
3 試劑和材料
注:除非另有說明,本方法所用試劑均為分析純,水為GB/T 6682規定的一級水。
3.1 試劑
3.1.1 磷酸氫二鉀(K2HPO4)。
3.1.2 辛烷磺酸鈉(C8H17NaO3S)。
3.1.3 鹽酸(HCl):含量:36%~38%。
3.1.4 磷酸(H3PO4)。
3.1.5 硅藻土(SiO2):粒徑范圍:0.2-0.8mm。
3.1.6 乙腈(CH3CN):色譜純。
3.2 標準品
左旋肉堿標準樣品的分子式、相對分子量、CAS登錄號見表1,純度≥98%,或經國家認證并授予標準物質證書的標準物質。
表1 左旋肉堿標準樣品的中文名稱、英文名稱、CAS登錄號、分子式、相對分子量
中文名稱
英文名稱
CAS登錄號
分子式
相對分子量
左旋肉堿
L-Carnitine
541-15-1
C7H15NO3
161.20
3.3 標準溶液配制
3.3.1 左旋肉堿標準儲備液:稱取25mg(準確至0.01mg)左旋肉堿標準品(3.2)于25mL容量瓶中,用鹽酸溶液(3.4)溶解并定容至刻度,搖勻。此溶液濃度為1.0mg/mL。
3.3.2 左旋肉堿標準系列工作液:分別準確吸取左旋肉堿標準儲備液(3.3.1)0.50mL、1.0mL、2.0mL、3.0mL、4.0mL、5.0mL于5mL容量瓶中,用鹽酸溶液(3.4)稀釋至刻度,得濃度分別為0.10mg/mL、0.20mg/mL、0.40mg/mL、0.60mg/mL、0.80mg/mL、1.00mg/mL的標準系列工作液。臨用時配制。
3.4 鹽酸溶液(0.5mmol/L):準確吸取4.2mL鹽酸(3.1.3),用水定容至100mL。搖勻后,再吸取上述溶液1.0mL,用水定容至1L。
3.5 緩沖鹽溶液:分別準確稱取3.4g磷酸氫二鉀(3.1.1)和0.4325g辛烷磺酸鈉(3.1.2),用水溶解并定容至1L,搖勻,用磷酸(3.1.4)調至pH=2.5,經微孔濾膜(3.6)過濾,待用。
3.6 微孔濾膜:0.45μm,水相。
4 儀器和設備
4.1 高效液相色譜儀:配有紫外(UV)檢測器或二極管陣列(DAD)檢測器。
4.2 分析天平:感量分別為0.01mg、0.0001g和0.001g。
4.3 超聲波提取器:功率250W,頻率33kHz。
5 分析步驟
5.1 試樣制備
5.1.1 試樣提取
5.1.1.1 固體試樣
準確稱取粉碎并混合均勻的試樣0.1g~2g(準確至0.0001g,含待測組分約5mg~50mg),于50mL容量瓶中,加入鹽酸溶液(3.4)約35mL,超聲提取10min,放至室溫,用鹽酸溶液(3.4)稀釋至刻度,搖勻,過濾,棄初濾液,收集續濾液,再經微孔濾膜(3.6)過濾,續濾液進液相色譜儀分析。
5.1.1.2 軟膠囊試樣
取軟膠囊剪開,擠出內容物并混勻,準確稱取2g(準確至0.0001g),準確加入等量硅藻土(3.1.5),研至分散均勻,準確稱取其中部分(準確至0.0001g,含待測組分約5mg~50mg),轉移至250mL具塞三角瓶中,吸取鹽酸溶液(3.4)50.0mL,并入三角瓶中,稱重(準確至0.001g),加塞超聲提取10min,放至室溫,用鹽酸溶液(3.4)補足重量,搖勻,過濾,棄初濾液,收集續濾液,再經微孔濾膜(3.6)過濾,續濾液進液相色譜儀分析。
5.1.1.3 液體試樣
準確吸取混勻后的試樣1.0mL~5.0mL(含待測組分約5mg~50mg),于50mL容量瓶中,加入鹽酸溶液(3.4)約35mL,超聲提取10min,放至室溫,用鹽酸溶液(3.4)稀釋至刻度,搖勻,過濾,棄初濾液,收集續濾液,再經微孔濾膜(3.6)過濾,續濾液進液相色譜儀分析。
5.1.2 試樣溶液稀釋
必要時,根據試樣溶液中左旋肉堿含量,用鹽酸溶液(3.4)進行適當的稀釋(稀釋倍數F),使待測溶液中左旋肉堿的濃度在0.10mg/mL~1.00mg/mL范圍內。
5.2 儀器參考條件
5.2.1 色譜柱:C18柱: 250mm×4.6mm,5μm或同等性能的色譜柱。
5.2.2 流動相:緩沖鹽溶液(3.5)+乙腈(3.1.6),(90+10,v/v)。
5.2.3 流速:0.8mL/min。
5.2.4 檢測波長:210nm。
5.2.5 進樣量:20μL。
5.3 標準曲線的制作
將左旋肉堿標準系列工作液(3.3.2)分別按液相色譜參考條件(5.2)進行測定,得到相應的左旋肉堿標準溶液的色譜峰面積。以標準工作液的濃度為橫坐標,以峰面積為縱坐標,繪制標準曲線。
5.4 待測溶液的測定
將待測溶液(5.1)按液相色譜參考條件(5.2)進行測定,得到相應的待測溶液左旋肉堿的色譜峰面積,根據標準曲線得到待測溶液中左旋肉堿的濃度,平行測定次數不少于兩次。
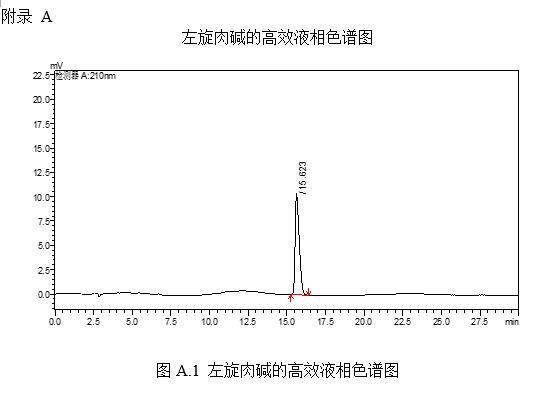
左旋肉堿的標準液相色譜圖參見附錄A的圖A.1。
6 結果計算
試樣中左旋肉堿含量按下式計算:
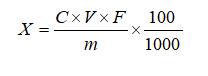
式中:
X—試樣中左旋肉堿的含量,固體和軟膠囊試樣的單位為克每百克(g/100g),液體試樣的單位為克每百毫升(g/100mL);
C—根據標準曲線計算待測溶液中左旋肉堿的濃度,單位為毫克每毫升(mg/mL);
V—試樣提取時的定容體積,單位為毫升(mL);
m—試樣稱取的質量,單位為克(g);或液體試樣吸取的體積,單位為毫升(mL);
F—稀釋倍數;
100—單位轉換;
1000—單位轉換。
計算結果以重復性條件下獲得的兩次獨立測定結果的算術平均值表示,結果保留三位有效數字。
7 精密度
在重復性條件下獲得的兩次獨立測定結果的絕對差值不超過算術平均值的10%。