根據國家市場監管總局 2021 年 2 月 1 日 發布的《輔酶 Q10 等五種保健食品原料備案產品劑型及技術要求》配套解讀可知:輔酶 Q10 、褪黑素、螺旋藻、破壁靈芝孢子粉、魚油五種原料制成的單方產品的備案僅針對國產保健食品,不包括首次進口的保健食品。目前,首次進口的這 5 類產品仍然需要按照《保健食品注冊與備案管理辦法》要求,向國家市場監管總局申請注冊。
瑞旭集團推斷,在《食品安全法》修訂并實施前,進口輔酶Q10 等產品仍舊需要執行注冊管理制度。因此,在本篇文章中,瑞旭集團整理對比了進口保健食品注冊與備案的主要區別,幫助進口企業深入了解在中國市場準入過程中的優劣勢。
1. 進口保健食品注冊與備案的申報范圍
目前,根據《食品安全法》以及《保健食品注冊與備案管理辦法》的相關規定,首次進口的保健食品注冊與備案的申報范圍分別為:
n 備案: 首次進口的屬于補充維生素、礦物質等營養物質的保健食品(即:營養素補充劑需申請備案)。
n 注冊: 除營養素補充劑外,其他首次進口的保健食品需要申請注冊(即:功能性保健食品需申請注冊)。
2. 注冊與備案的試驗要求區別
毫無疑問的,申請注冊要比備案多做更多的試驗。兩者需要開展的試驗如下表所示:
|
注冊試驗項 目 |
l 3 批次產品技術要求全項目檢驗; l 3 批次產品的功效成分或標志性成分、衛生學、穩定性試驗; l 1 批次毒理學試驗; l 1 批次動物功能試驗和(或)人體試食試驗; l 功效成分或標志性成分方法學驗證; l 其他需要的試驗,例如采用了特殊的原料。 |
|
備案試驗項目 |
l 3 批次產品技術要求全項目檢驗; l 3 批次產品的功效成分或標志性成分、衛生學、穩定性檢驗; l 原料的全項目檢驗報告(僅限輔酶 Q10 等5個功能性原料); l 功效成分或標志性成分方法學驗證(若有需要)。 |
對比可知,注冊需要額外開展的試驗主要在于:毒理學試驗、動物功能試驗和(或)人體試食試驗。不同的保健功能需要開展的功能評價試驗均不同,而對于輔酶Q10 等5個原料制成的單方產品而言,與國產備案相比,進口產品申請注冊需要額外進行的試驗主要包括:
Ø 輔酶Q10 (增強免疫力): 毒理學試驗 ,動物功能試驗
Ø 輔酶Q10 (抗氧化): 毒理學試驗 ,動物功能試驗,人體試食試驗
Ø 魚油(輔助降血脂): 毒理學試驗 ,動物功能試驗,人體試食試驗
Ø 褪黑素(改善睡眠): 毒理學試驗 ,動物功能試驗
Ø 破壁靈芝孢子粉(增強免疫力): 毒理學試驗 ,動物功能試驗
Ø 螺旋藻(增強免疫力): 毒理學試驗 ,動物功能試驗
3. 卷宗要求區別
除提交的試驗報告不同外,保健食品注冊與備案在卷宗要求中最主要的區別在于:注冊需要提交完整的產品研發報告。而對備案產品而言,由于從原料到產品的要求都是規范化、標準化的,因此,無需提交產品研發報告。
對于輔酶 Q 10 等 5 個單一原料制成的進口產品,在注冊申報過程中,應按要求提交產品研發報告。但由于輔酶 Q 10 等 5 種原料在我國本有長久食用歷史,且配方研究成熟,最重要的是已在保健食品原料目錄中,因此《輔酶 Q 10 等五種保健食品原料目錄》和《輔酶 Q 10 等五種保健食品原料備案產品劑型及技術要求》可以作為產品研發報告的最主要的一個依據。對比其他進口功能性保健食品,輔酶 Q 10 等 5 種原料制成的單一配方的進口保健食品,在研發報告的撰寫上要容易許多,企業無需擔心這點。
|
項目 |
注冊 |
備案 |
|
卷宗要求區別 |
l 需提供完整的產品研發報告,包括: 1) 安全性論證報告; 2) 保健功能論證報告; 3) 生產工藝研究報告; 4) 產品技術要求研究; |
l 無研發報告要求; |
4. 申報流程區別
n 進口保健食品注冊申報流程簡圖
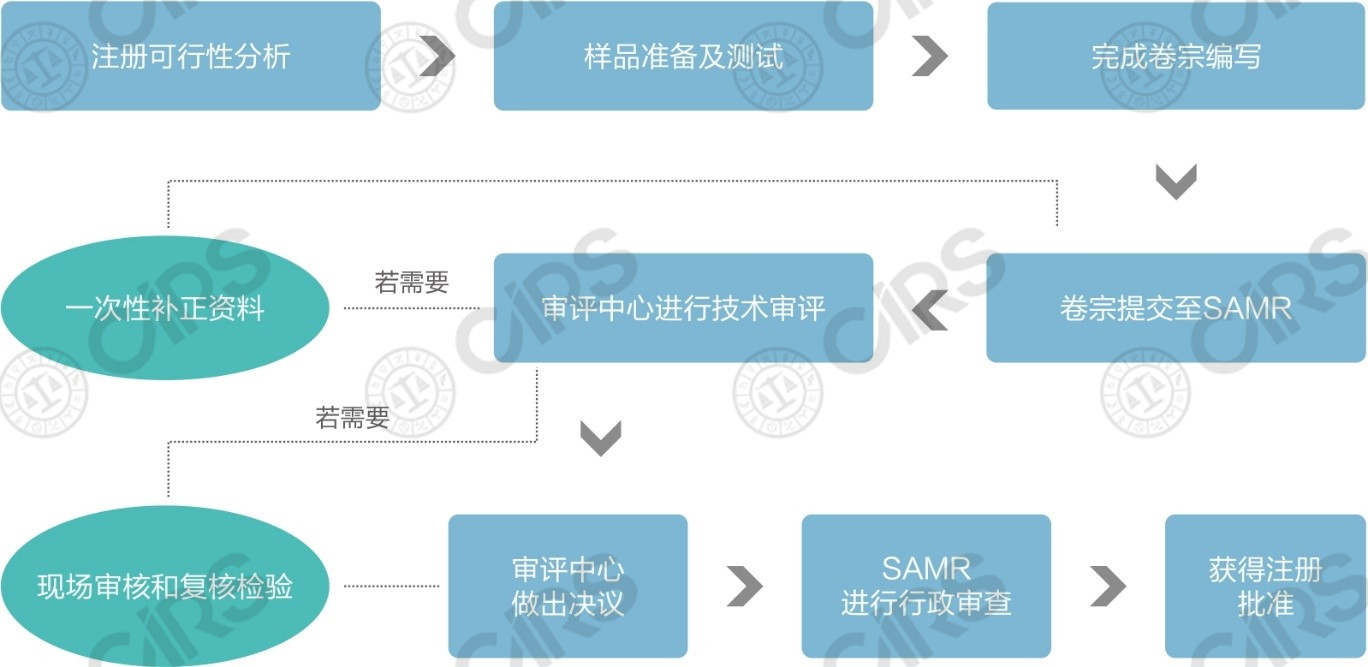
n 進口保健食品備案申報流程簡圖
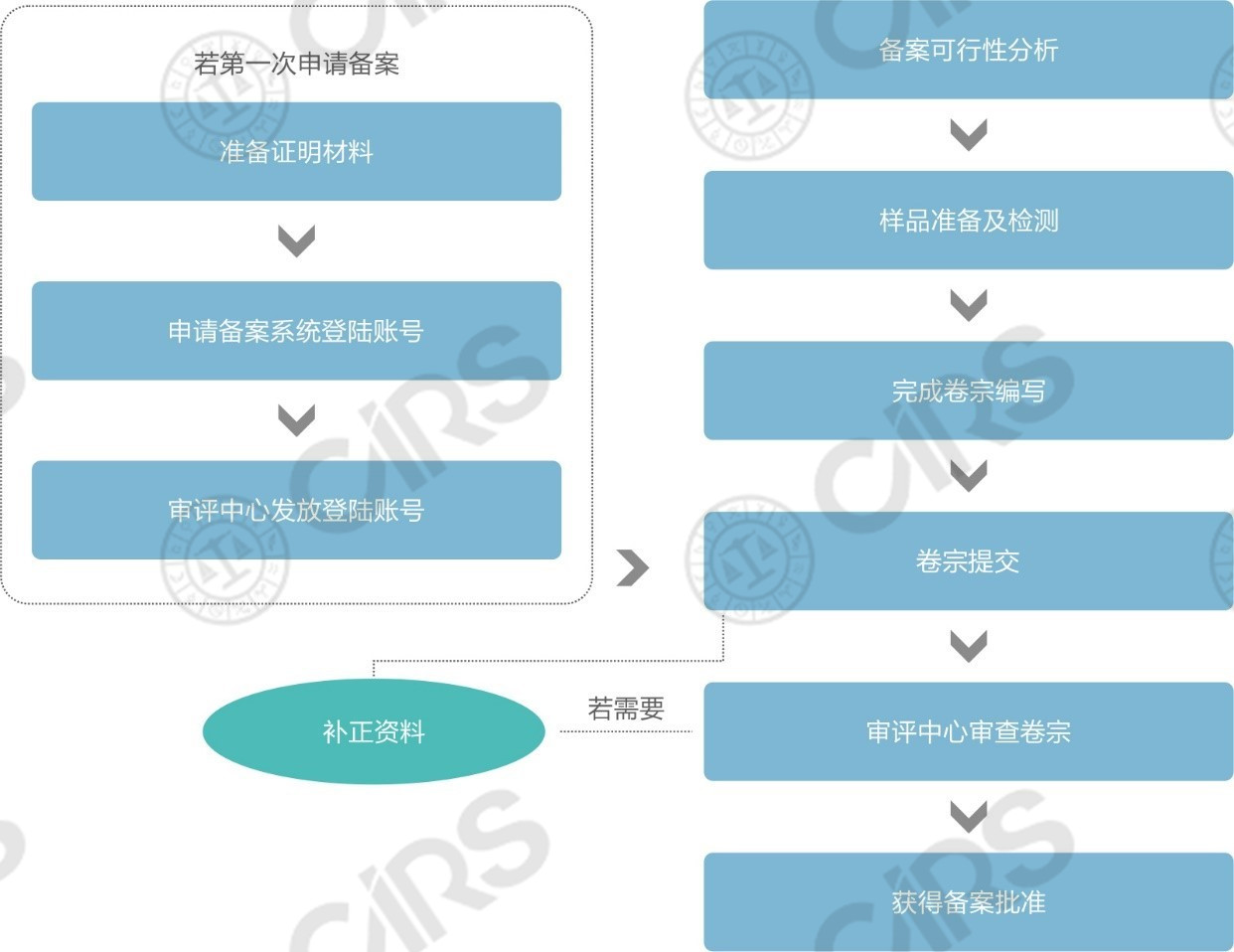
比對上述兩個流程圖,進口保健食品注冊與備案在申報流程上的區別主要包括以下四方面:
|
流程區別 |
注冊 |
備案 |
|
系統賬號申請 |
填寫信息后即刻獲得注冊系統賬號,無需經過人工審核 |
進口產品在首次備案前應準備好“申請人資質證明材料、聯系人授權書、法人護照”三份文件向食品審評中心申請備案系統賬號,食品審評中心人工審核通過后向企業發放賬號 |
|
專家技術審評 |
需經過專家技術審評,審評組包括: l 安全性專家審查組 l 保健功能專家審查組 l 工藝專家審查組 l 產品技術要求專家審查組 |
無需專家技術審評,備案材料由食品審評中心工作人員進行審查 |
|
現場核查與復核檢驗 |
視技術審評情況,可能需要開展 |
無需 |
|
國家市場監督管理總局(SAMR)的行政審批 |
需要,產品 經國家市場監督管理總局行政審批,做出批準決定后方能獲得注冊 |
無需 |
5 . 周期對比
基于上述的試驗要求、卷宗要求、申報流程等方面的區別,進口保健食品注冊與備案在整個申報周期上的對比如下:
|
主要流程 |
預估周期(進口注冊) |
預估周期(進口備案) |
|
申報可行性分析 |
7 個工作日 |
3 個工作日 |
|
申請人樣品準備 |
視申請人準備情況 |
視申請人準備情況 |
|
試驗檢測 |
8-16 個月 (主要視產品功能而定) |
4 個月 |
|
卷宗編寫與提交 |
2 個月 |
1 個月內 |
|
受理機構受理 |
5 個工作日內 |
/ ( 線上提交即可) |
|
注冊技術審評, 或食品審評中心的備案審查 |
60 個工作日內 |
一般1-2個月 |
|
補正材料(若有需要) |
3 個月內 |
視補正要求而定 (一般1個月內) |
|
再次注冊技術審評/備案審查 |
60 個工作日內 |
一般1-2個月 |
|
現場核查和復核檢驗(若有需要) |
進口產品視情況而定 (國產:90個工作日) |
/ |
|
審評中心報送結果至SAMR |
5 個工作日內 |
/ |
|
SAMR 行政審查,做出審批決定 |
20 個工作日內 |
/ |
|
將審批材料移交受理機構 |
3 個工作日內 |
/ |
|
受理機構向申請人發出批準證書 |
10 個工作日內 |
備案系統直接發出證書 |
|
合計 |
15+ 個月 |
8-10 個月 |
如前文所述,注冊產品需要額外開展包括毒理學試驗、功能性評價等試驗,因此整體申報周期比備案長。
而對于輔酶 Q 10 、褪黑素、破壁靈芝孢子粉、魚油、螺旋藻這 5 個原料制成的單方產品而言,由于配方簡單且成熟、安全性有充分的論證,在卷宗編寫、專家技術審評、補正材料等階段會比其他的注冊類產品會更為順利,節約更多的時間,預計 15 個月或可拿下進口注冊證書。
進口備案方面,除申請人準備的卷宗質量優劣外,以下兩方面也會對整體備案周期產生影響。其一:首次申報的企業需獲取備案系統登錄賬號。申請人向食品審評中心提交申請后一般需等待1個月左右出結果。而進口保健食品備案系統賬號的申請是存在一定難度的,若申請人不了解相關要求,極容易被多次退回,甚至花費1年以上的時間來獲取賬號。因此,申請人應盡早申請,勿等到產品的備案試驗都已完成還未獲取賬號,空等一段時間來申請賬號。其二:進口產品提交備案申請后需由食品審評中心進行材料審查。該階段的審查周期法規中并無具體的規定,因此會存在一定的浮動范圍,目前審評中心的反饋周期一般在1-2個月。
6. 結語
綜上所述,進口保健食品注冊與備案在“申報范圍”、“試驗要求”、“卷宗要求”、“申報流程”等方面均有不同規定,因而導致這兩種準入方式在申報周期以及企業花費的成本上均存在差異。毫無疑問的是,保健食品注冊比備案的周期更長,費用更高。但 輔酶 Q 10 等五個單一原料制成的進口保健食品在注冊時又存在一定的特殊性。
目前, 輔酶 Q 10 等五個單一原料制成的國產產品已經納入備案范圍,進口的仍需要申請注冊。但根據上述文章的分析,注冊時研發報告的準備不再是難點,周期上多出的半年時間也能被大部分企業接受。除此之外,在系統賬號的申請上,注冊賬號是系統申請立即拿到,備案賬號倒有可能需要補正多次方可拿到。 雖然輔酶 Q 10 等產品的注冊花費的成本和周期相比備案有所增加,但有實際需求的進口企業或許也不必對注冊望而卻步,在《食品安全法》修訂前,可及時布局搶占進口產品的市場。
我們的服務:
