中文名稱:國家市場監督管理總局 國家衛生健康委員會 國家中醫藥管理局關于發布輔酶Q10等五種保健食品原料目錄的公告
英文名稱: Health Food Raw Material Directory of Coenzyme Q10, Melatonin, Fish oil, Broken Ganoderma lucidum spore powder and Spirulina
發布時間: 2020/12/01
實施時間: 2021/03/01
發布單位:國家市場監督管理總局 國家衛生健康委員會 國家中醫藥管理局
國家市場監督管理總局 國家衛生健康委員會 國家中醫藥管理局關于發布輔酶Q10 等五種保健食品原料目錄的公告
根據《中華人民共和國食品安全法》《保健食品原料目錄與保健功能目錄管理辦法》等規定,國家市場監督管理總局會同國家衛生健康委員會、國家中醫藥管理局制定了輔酶Q10等五種保健食品原料目錄,現予發布,自2021年3月1日起施行。
附件:1.《保健食品原料目錄 輔酶Q10》
2.《保健食品原料目錄 破壁靈芝孢子粉》
3.《保健食品原料目錄 螺旋藻》
4.《保健食品原料目錄 魚油》
5.《保健食品原料目錄 褪黑素》
市場監管總局 衛生健康委
中醫藥局
2020年11月23日
附件1
《保健食品原料目錄 輔酶 Q10 》
|
原料名稱 |
每日用量 |
功效 |
|||
|
名稱 |
用量范圍 |
適宜人群 |
不適宜人群 |
注意事項 |
|
|
輔酶 Q10 |
30-50mg |
成人 |
少年兒童、孕婦、乳母、過敏體質人群 |
服用治療藥物的人群食用本品時應向醫生咨詢 |
增強免疫力 抗氧化 |
輔酶 Q10 原料技術要求
【來源】
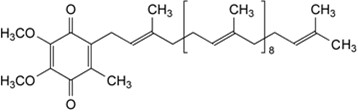
輔酶Q10 原料來源于微生物(酵母菌或類球紅細菌)經發酵、提取、精制;或動物心臟經提取、精制;或茄尼醇經合成、精制等過程制得。化合物名稱為2-[(全-E)-3,7,11,15,19,23,27,31,35,39-十甲基-2,6,10,14,18,22,26,30,34,38-四十癸烯基]-5,6-二甲氧基 -3-甲基-p-苯醌,分子式為C59H90O4 。結構式如下:
【感官要求】
應符合表1規定。
表1 感官指標
|
項目 |
要求 |
|
色澤 |
黃色至橙黃色 |
|
滋味、氣味 |
無臭無味 |
|
狀態 |
結晶性粉末 |
【鑒別】
1. 取含量測定項下的供試品溶液,加硼氫化鈉50mg,搖勻,溶液黃色消失。
2. 在含量測定項下記錄的色譜圖中,供試品溶液主峰的保留時間應與對照品溶液主峰的保留時間一致。
3. 本品的紅外光吸收圖譜應與對照的圖譜(光譜集1046圖)一致。
【理化指標】
應符合表2規定。
表2 理化指標
|
項目 |
指標 |
檢驗方法 |
|
有關物質, 單個雜質 ,% ≤ |
0.5 |
1 有關物質的測定 |
|
總雜質, % ≤ |
1.0 |
|
|
順式異構體, % ≤ |
0.5 |
2 順式異構體的測定 |
|
熾灼殘渣, % ≤ |
0.1 |
3 熾灼殘渣的測定 |
|
鉛(以 Pb 計), mg/kg ≤ |
2.0 |
GB 5009.12 |
|
總砷(以 As 計), mg/kg ≤ |
1.0 |
GB 5009.11 |
|
總汞(以 Hg 計), mg/kg ≤ |
0.3 |
GB 5009.17 |
1 有關物質的測定
1.1試劑和材料
1.1.1 甲醇:色譜純
1.1.2 無水乙醇:色譜純
1.1.3輔酶Q10 和輔酶Q9 對照品
1.2儀器和設備
1.2.1 電子天平
1.2.2 水浴鍋
1.2.3 高效液相色譜儀
1.3供試品溶液的制備
避光操作。精密稱取輔酶Q10 原料約20mg,加無水乙醇40mL,在50℃水浴中振搖溶解,放冷后,移至100mL量瓶中,用無水乙醇稀釋定容至刻度,搖勻,制成每1 mL中約含0.2mg的溶液,作為供試品溶液。
1.4對照溶液的制備
避光操作。精密量取供試品溶液1mL,置100mL量瓶中,用無水乙醇稀釋定容至刻度,搖勻,制成每1 mL中約含2μg的溶液,作為對照溶液。
1.5 系統適用性溶液的制備
避光操作。精密稱取輔酶Q10 對照品和輔酶Q9 對照品適量,用無水乙醇溶解并稀釋制成每1 mL中各約含0.2mg的混合溶液,作為系統適用性溶液。
1.6靈敏度溶液的制備
避光操作。精密量取對照溶液1mL,置20mL量瓶中,用無水乙醇稀釋定容至刻度,搖勻,制成每1mL中約含0.1μg的溶液,作為靈敏度溶液。
1.7測定
色譜條件:用十八烷基硅烷鍵合硅膠為填充劑;流動相:甲醇-無水乙醇(1:1);柱溫:35℃;檢測波長:275nm;進樣量:20μL。
系統適用性要求:取系統適用性溶液注入高效液相色譜儀,記錄色譜圖。輔酶Q9 峰和輔酶Q10 峰之間的分離度應大于6.5,理論板數按輔酶Q10 峰計算不低于3000。
靈敏度要求:取靈敏度溶液注入高效液相色譜儀,記錄色譜圖。主成分色譜峰高的信噪比不小于10。
將上述溶液依次注入高效液相色譜儀,記錄色譜圖至主成分峰保留時間的2倍。分別測量靈敏度溶液、對照溶液色譜圖中的主峰面積和供試品溶液色譜圖中所有峰的面積。供試品溶液色譜圖中小于靈敏度溶液主峰面積的峰忽略不計。供試品溶液色譜圖中如有雜質峰,單個雜質峰面積不得大于對照溶液主峰面積的0.5倍(0.5%),各雜質峰面積的和不得大于對照溶液的主峰面積(1.0%)。
1.8結果計算
1.8.1單個雜質的含量計算:
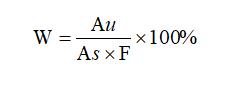
式中:
W:單個雜質的含量,%;
Au :供試品溶液中(除去主峰)單個雜質的峰面積;
As :對照溶液的主峰面積;
F:稀釋倍數為100。
1.8.2總雜質的含量計算:
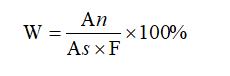
式中:
W:總雜質的含量,%;
An :供試品溶液中(除去主峰)各雜質峰面積的和;
As :對照溶液的主峰面積;
F:稀釋倍數為100。
2 順式異構體的測定
2.1 試劑和材料
2.1.1 30%過氧化氫溶液:分析純
2.1.2 正己烷:色譜純
2.1.3 乙酸乙酯:色譜純
2.2儀器和設備
2.2.1 電子天平
2.2.2 光照箱
2.2.3 高效液相色譜儀
2.3 供試品溶液的制備
避光操作,臨用新制。精密稱取輔酶Q10 原料,加正己烷溶解并稀釋制成每1mL中約含1mg的溶液,搖勻,作為供試品溶液。
2.4 對照溶液的制備
避光操作,臨用新制。精密量取供試品溶液1mL置200mL量瓶中,用正己烷稀釋制成每1mL中約含5μg的溶液,搖勻,作為對照溶液。
2.5 系統適用性溶液的制備
避光操作,臨用新制。精密稱取輔酶Q10 原料約10mg,加正己烷溶解并稀釋制成每1mL中約含1mg的溶液,加入30%過氧化氫溶液2μL,置光照箱(溫度30℃,LX2000)下放置4小時,搖勻,作為系統適用性溶液。
2.6 測定
色譜條件:用硅膠為填充劑;色譜柱規格:4.6mm×250mm,5μm;流動相:正己烷-乙酸乙酯(97:3)。檢測波長:275nm;流速:2.0mL/min;進樣量:20μL。
系統適應性要求:取系統適用性溶液注入高效液相色譜儀,記錄色譜圖。輔酶Q10 峰的保留時間約為10分鐘,色譜圖中相對主峰保留時間約為0.9的色譜峰為順式異構體峰,順式異構體峰與輔酶Q10 峰之間的分離度應大于1.5。
將上述對照溶液和供試品溶液依次注入高效液相色譜儀,記錄色譜圖。分別測量對照溶液的主峰面積和供試品溶液色譜圖中順式異構體的峰面積。供試品溶液色譜圖中如有與順式異構體保留時間一致的色譜峰,其峰面積不得大于對照溶液的主峰面積(0.5%)。
2.7 結果計算
順式異構體的含量計算:
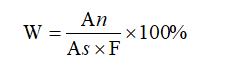
式中:
W:順式異構體的含量,%;
An :供試品溶液中順式異構體的峰面積;
As :對照溶液的主峰面積;
F:稀釋倍數為200。
3 熾灼殘渣的測定
稱取輔酶Q10 原料約1.0g,置已熾灼至恒重的坩堝中,精密稱定,緩緩熾灼至完全炭化,放冷后,加硫酸0.5〜1mL使濕潤,低溫加熱至硫酸蒸氣除盡后,在700〜800℃熾灼使完全灰化,移置干燥器內,放冷,精密稱定后,再在700〜800℃熾灼至恒重,即得。
【微生物指標】
應符合表3規定。
表 3 微生物指標
|
項目 |
指標 |
檢驗方法 |
|
菌落總數, CFU/g ≤ |
30000 |
GB 4789.2 |
|
霉菌和酵母, CFU/g ≤ |
50 |
GB 4789.15 |
|
大腸菌群, MPN/g ≤ |
0.92 |
GB 4789.3 MPN 計數法 |
|
沙門氏菌 ≤ |
0/25g |
GB 4789.4 |
|
金黃色葡萄球菌 ≤ |
0/25g |
GB 4789.10 |
【標志性成分指標】
應符合表4規定。
表 4 標志性成分指標
|
項目 |
指標 |
檢驗方法 |
|
輔酶 Q10 , % |
98.0-101.0 |
4 輔酶 Q10 的含量測定 |
4輔酶Q10的含量測定
4.1試劑和材料
4.1.1輔酶Q10 和輔酶Q9 對照品
4.1.2 甲醇:色譜純
4.1.3 無水乙醇:色譜純
4.2儀器和設備
4.2.1 電子天平
4.2.2 水浴鍋
4.2.3 高效液相色譜儀
4.3 供試品溶液的制備
同有關物質測定項下。
4.4 對照品溶液的制備
避光操作。精密稱取輔酶Q10 對照品約20mg,加無水乙醇40mL,在50℃水浴中振搖溶解,放冷后,移至100mL量瓶中,用無水乙醇稀釋定容至刻度,搖勻,制成每1 mL中約含0.2mg的溶液,作為對照品溶液。
4.5 測定
色譜條件和系統適用性要求同有關物質測定項下。
將上述對照品溶液和供試品溶液依次注入高效液相色譜儀,記錄色譜圖。按外標法以峰面積計算。
4.6 結果計算
輔酶Q10 含量計算:
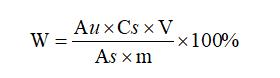
式中:
W:輔酶Q10 含量,%;
Au :供試品溶液的峰面積;
As :對照品溶液的峰面積;
m:供試品溶液的稱樣量(mg);
V:供試品溶液的定容體積(mL);
Cs :對照品溶液的濃度(mg/mL)。
4.7 精密度
在重復性條件下獲得的兩次獨立測定結果的絕對差值不得超過算數平均值的2%。
【儲存】遮光、密封,在陰涼處保存。
【產品的劑型】片劑、顆粒劑、硬膠囊、軟膠囊
——————————
附件2
《保健食品原料目錄 破壁靈芝孢子粉》
|
原料名稱 |
每日用量 |
功效 |
|||
|
名稱 |
用量范圍 |
適宜人群 |
不適宜人群 |
注意事項 |
|
|
破壁靈芝孢子粉 |
1-4g |
免疫力低下者 |
少年兒童、孕婦及乳母 |
|
增強免疫力 |
破壁靈芝孢子粉原料技術要求
【來源】
破壁靈芝孢子粉為多孔菌科真菌赤芝(Ganoderma lucidum (Leyss. ex Fr.) Karst.)、紫芝(Ganoderma sinense Zhao, Xu et Zhang)、松杉靈芝(Ganoderma tsugae)的干燥成熟孢子,經滅菌(輻照滅菌和濕熱滅菌等滅菌方法),干燥,低溫物理破壁,過篩制得。
【感官要求】
應符合表1規定。
表1 感官指標
|
項目 |
要求 |
|
色澤 |
棕褐色 |
|
滋味、氣味 |
氣微,味淡或微苦 |
|
狀態 |
無結塊,干燥疏松細膩粉末,無粘連,無沙粒感,無正常視力可見外來異物 |
【鑒別】
顯微鑒別:粉末棕褐色,置顯微鏡下觀察,孢壁多破碎,可見多數黃褐色的大小不等的微粒、孢子破碎程度不同的殼段或孢子破碎后里面的黃色至黃褐色的內容物,少見有未破壁的孢子,不得檢出子實體、菌絲、淀粉粒等異物。
【理化指標】
應符合表2規定。
表2 理化指標
|
項目 |
指標 |
檢驗方法 |
|
破壁率 % ≥ |
95 |
1 破壁率的測定 |
|
水分, % ≤ |
9.0 |
GB 5009.3 |
|
總灰分, % ≤ |
3.0 |
GB 5009.4 |
|
鉛 (以 Pb 計), mg/kg ≤ |
2.0 |
GB5009.12 |
|
砷 (以 As 計), mg/kg ≤ |
1 |
GB/T 5009.11 |
|
汞 (以 Hg 計), mg/kg ≤ |
0.1 |
GB/T 5009.17 |
|
鎘 (以 Cd 計), mg/kg ≤ |
0.5 |
GB5009.15 |
|
鎳 (以 Ni 計), mg/kg ≤ |
1.0 |
GB/T 5009.138 |
|
鉻 (以 Cr 計), mg/kg ≤ |
2.0 |
GB/T 5009.123 |
|
過氧化值(以靈芝孢子油計), g/100g ≤ |
0.20 |
GB5009.227 |
1 破壁率的測定
1.1 儀器與設備
1.1.1 血球計數板:25個中格×16個小格或16個中格×25個小格。
1.1.2 電子分析天平:精度0.1 mg。
1.1.3 超聲波清洗器:功率≥45 W。
1.1.4 光學顯微鏡:放大倍數≥200。
1.1.5 烘箱。
1.2 試劑和溶液
除非另有規定,本方法中所用試劑均為分析純。
1.2.1 實驗用水應符合GB/T6682規定的三級水規格。
1.2.2 吐溫80。
1.2.3 蔗糖。
1.3 樣品制備
分別取同一批次有代表性靈芝孢子粉和破壁靈芝孢子粉的樣品各至少100 g,分別充分混勻,置于密閉的容器內。
1.4 分析步驟
1.4.1 取適量同一批次的靈芝孢子粉A和破壁靈芝孢子粉B,于烘箱60℃下烘干5 h。
1.4.2 準確稱取經烘干的孢子粉A和破壁靈芝孢子粉B,其中mA=0.1000 g,mB=0.1500 g。
1.4.3 分別稱取5.0 g經過研磨后過100目篩的蔗糖粉末,分別與孢子粉A、B充分混合至色澤均一。用蒸餾水分別溶解上述樣品,在樣品溶液中加0.1 mL吐溫80,用蒸餾水定容到100 mL的容量瓶中,并在室溫超聲震蕩30 min,使孢子充分分散。
1.4.4 將待測孢子懸液,用吸管吸取一滴置于蓋玻片的邊緣,使液體緩緩滲入,多余的液體用吸水紙吸取,進樣完成后靜置約30 s,然后將血球計數板置于200倍及以上放大倍數的光學顯微鏡下進行觀察計數。
1.4.5 使用25個中格×16個小格的計數板時,應計算出血球計數板4個角上與中央5個中格中含完整靈芝孢子的數目(即以80個小格為一個計數單位);當使用16個中格×25個小格的計數板時,應計算出血球計數板4個角上的4個中格中含完整靈芝孢子的數目(即以100個小格為一個計數單位)。如有部分孢子處于中格邊線上,計數時應該僅統計位于中格四個邊線的其中兩個邊線的孢子數,每個樣品觀察計數時應去掉離群較大的值,每個樣品有效觀察計數不少于3次,然后計算它們的平均數n。
1.5 結果計算
1.5.1 使用25個中格×16個小格的計數板時,每克孢子粉中含完整靈芝孢子數按式(1.1)計算:
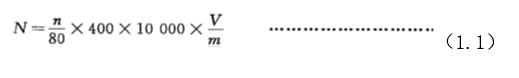
式中:
N——每克孢子粉含完整的靈芝孢子數,單位為個每克(個/g);
n——80個小方格內含完整靈芝孢子的總數,單位為個;
V——孢子稀釋液的體積,單位為毫升(mL);
m——樣品的質量,單位為克(g);
400——血球計數板的計數室內共有400個小方格;
10000——血球計數板計數室的容積為0.1mm3,1mL相當于10000個血球計數板計數室的容積。
1.5.2 使用16個中格×25個小格的計數板時,每克孢子粉中含完整靈芝孢子數按式(1.2)計算:
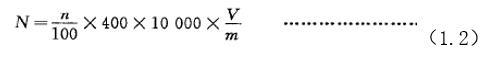
式中:
N——每克孢子粉含完整的靈芝孢子數,單位為個每克(個/g);
n——100個小方格內含完整靈芝孢子的總數,單位為個;
V——孢子稀釋液的體積,單位為毫升(mL);
m——樣品的質量,單位為克(g);
400——血球計數板的計數室內共有400個小方格;
10000——血球計數板計數室的容積為0.1 mm3,1 mL相當于10000個血球計數板計數室的容積。
1.5.3 破壁率按式(1.3)計算:

式中:
X——破壁靈芝孢子粉的破壁率,%;
NB——每克破壁靈芝孢子粉中含完整的靈芝孢子數,單位為個每克(個/g);
NA——每克靈芝孢子粉中含完整的靈芝孢子數,單位為個每克(個/g)。
【微生物指標】
應符合表3規定。
表3 微生物指標
|
項目 |
指標 |
檢驗方法 |
|
菌落總數, CFU/g ≤ |
30000 |
GB 4789.2 |
|
霉菌和酵母, CFU/g ≤ |
50 |
GB 4789.15 |
|
大腸菌群, MPN/g ≤ |
0.92 |
GB 4789.3 MPN 計數法 |
|
沙門氏菌 ≤ |
0/25g |
GB 4789.4 |
|
金黃色葡萄球菌 ≤ |
0/25g |
GB 4789.10 |
【標志性成分指標】
應符合表4規定。
表4標志性成分指標
|
項目 |
指標 |
檢驗方法 |
|
多糖, % ≥ |
0.9 (以無水葡萄糖( C6H12O6 )計) |
2 多糖的測定 |
2 多糖的測定
2.1試劑和材料
2.1.1硫酸(分析純)
2.1.2葡萄糖(分析純)
2.1.3無水乙醇(分析純)
2.1.4硫酸蒽酮溶液:精密稱取蒽酮0.1 g,加硫酸溶液100 mL使溶解,搖勻,置于棕色瓶中即得。
2.2 儀器和設備
2.2.1分析天平(感量0.0001g)
2.2.2分光光度計
2.2.3玻璃回流裝置
2.2.4電熱恒溫水浴鍋
2.2.5容量瓶25 mL,50 mL容量瓶
2.2.6各規格移液管
2.2.7具塞試管25 mL
2.2.8濾紙(中速定性濾紙)。
2.3標準曲線的制備
2.3.1對照品溶液的制備
取無水葡萄糖對照品適量,精密稱定加水制成每1 mL含0.12 mg的溶液,即得。
2.3.2 標準曲線繪制
精密量取對照品溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,分別置于10 mL的具塞試管中,各加水至2.0 mL,迅速精密加入硫酸蒽酮溶液6 mL,立即搖勻,放置15 min,立即置冰水浴中冷卻15 min,取出,以相應的試劑為空白,在625 nm處測定吸光度,以吸光度為縱坐標,繪制標準曲線。
標準曲線圖
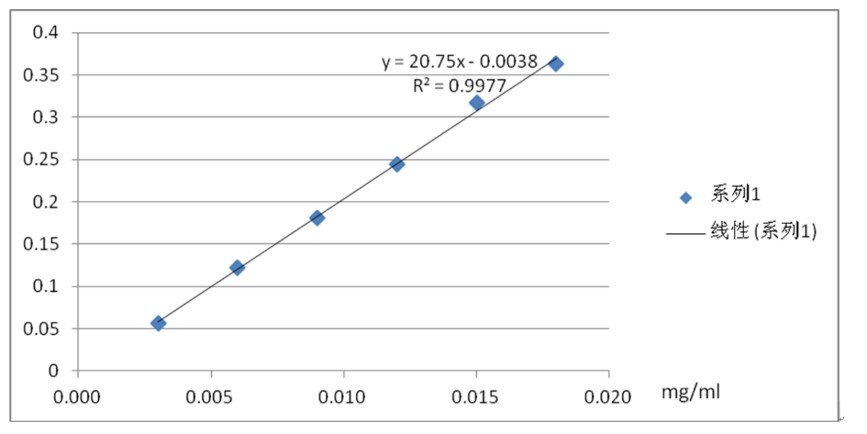
2.4供試品溶液的制備
取本品粉末約2 g,精密稱定,置圓底燒瓶中,加水60 mL,靜置1h,加熱回流4 h,趁熱過濾,用少量熱水洗滌濾器和濾渣,將濾紙和濾渣置圓底燒瓶中,加水60 mL,加熱回流3 h,趁熱過濾,合并濾液,置水浴鍋上蒸干,殘渣用水5 mL溶解,邊攪拌邊緩慢加入乙醇75 mL,搖勻,在4℃放置12 h,離心,棄去上清液,沉淀物用熱水溶解并轉移至50 mL,放冷,加水至刻度,搖勻取溶液適量,離心,精密量取上清液3 mL,置25 mL量瓶,加水至刻度,搖勻,即得。
2.5測定
精密量取供試品溶液2 mL,置10 mL具塞試管中,照標準曲線制備項下的方法,自“迅速精密加入硫酸蒽酮溶液6 mL”起,同法操作,測定吸光度,從標準曲線上讀出供試品溶液中無水葡萄糖的含量,計算即得。
2.6結果計算
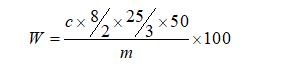
式中:
W-多糖的含量,%;
c-從標準曲線上查的樣品的多糖濃度,mg/mL;
m-樣品質量,mg;
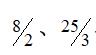 -表示稀釋倍數。
-表示稀釋倍數。
50-水提醇沉后獲得的沉淀物經熱水溶解定容的體積數值
【儲存】遮陰、密閉、陰涼處。
【產品的劑型】片劑、顆粒劑、硬膠囊、粉劑
——————————
附件3
《保健食品原料目錄 螺旋藻》
|
原料名稱 |
每日用量 |
功效 |
|||
|
名稱 |
用量范圍 |
適宜人群 |
不適宜人群 |
注意事項 |
|
|
螺旋藻 |
3-4g |
免疫力低下者 |
嬰幼兒、孕婦及乳母、過敏體質人群 |
|
增強免疫力 |
螺旋藻原料技術要求
【來源】
螺旋藻為鈍頂螺旋藻( Arthrospira platensis )和極大螺旋藻( Arthrospira maxima )經人工培養、采收、清洗的藻泥,經過噴霧干燥,或者其他干燥方法并經殺菌獲得的干粉。
【感官要求】
應符合表1規定。
表1 感官指標
|
項目 |
要求 |
|
色澤 |
藍綠色至墨綠色 |
|
滋味、氣味 |
無異味,略帶藻腥味 |
|
狀態 |
均勻干燥疏松粉末,無結塊,無正常視力可見外來雜質 |
【鑒別】
取少量樣品于水中,充分震蕩攪拌使藻粉顆粒分散,顯微鏡視野中應呈分散、綠色的S形、L形、C形或螺旋形的藻絲體,不得有明顯異物。
【理化指標】
應符合表2規定。
表2 理化指標
|
項目 |
指標 |
檢驗方法 |
|
水分, % ≤ |
7.0 |
GB 5009.3 第一法 |
|
總灰分, % ≤ |
7.0 |
GB 5009.4 |
|
蛋白質,% ≥ |
55.0 |
GB 5009.5 |
|
鉛(以 Pb 計), mg/kg ≤ |
2.0 |
GB 5009.12 |
|
砷(以 As 計), mg/kg ≤ |
1.0 |
GB 5009.11 |
|
汞(以 Hg 計), mg/kg ≤ |
0.3 |
GB 5009.17 |
|
鎘(以 Cd 計), mg/kg ≤ |
0.2 |
GB 5009.15 |
【微生物指標】
應符合表3規定。
表3 微生物指標
|
項目 |
指標 |
檢驗方法 |
|||
|
菌落總數, CFU/g ≤ |
30000 |
GB 4789.2 |
|||
|
霉菌和酵母, CFU/g ≤ |
50 |
GB 4789.15 |
|||
|
大腸菌群, MPN/g ≤ |
0.92 |
GB 4789.3 MPN 計數法 |
|||
|
沙門氏菌 ≤ |
0/25g |
GB 4789.4 |
|||
|
金黃色葡萄球菌 ≤ |
0/25g |
GB 4789.10 |
|||
|
副溶血性弧菌, MPN/g |
采樣量為 25g |
GB/T 4789.7 |
|||
|
n |
c |
m |
M |
||
|
5 |
1 |
100 MPN/g |
1000 MPN/g |
||
注:n為同一批次產品應采集的樣品件數;c為最大可允許超出m值的樣品數;m為致病菌指標可接受水平的限量值;M為致病菌指標的最高安全限量值。
【標志性成分指標】
應符合表4規定。
表4標志性成分指標
|
項目 |
指標 |
檢驗方法 |
|
β - 胡蘿卜素, g/kg ≥ |
0.20 |
1 β - 胡蘿卜素的測定 |
|
藻藍蛋白, % ≥ |
5.00 |
2 藻藍蛋白的測定 |
1β-胡蘿卜素的測定
1.1試劑和材料
1.1.1 氫氧化鉀溶液:稱固體氫氧化鉀500g,加入500mL水溶解。臨用前配制。
1.1.2 無水硫酸鈉(Na2SO4),分析純
1.1.3 抗壞血酸(C6H8O6),分析純
1.1.4 石油醚:沸程30℃~60℃,分析純
1.1.5 甲醇(CH4O),色譜純
1.1.6 乙腈(C2H3N),色譜純
1.1.7 甲基叔丁基醚[CH3OC(CH3)3],色譜純
1.1.8 二氯甲烷(CH2Cl2),色譜純
1.1.9 無水乙醇(C2H6O),優級純
1.1.10 水,符合GB/T6682規定的一級水
1.1.11 碘溶液(I2):0.5 mol/L濃度
1.1.12 2,6-二叔丁基-4-甲基苯酚(C15H24O,BHT)
1.2 儀器和設備
1.2.1 勻漿機
1.2.2 高速粉碎機
1.2.3 恒溫振蕩水浴箱(控溫精度±1℃)
1.2.4 旋轉蒸發器
1.2.5 氮吹儀
1.2.6 紫外-可見光分光光度計
1.2.7 高效液相色譜儀(帶紫外檢測器)
1.3 對照品溶液制備
1.3.1 β-胡蘿卜素標準儲備液(500μg/mL)
準確稱取β-胡蘿卜素標準品25mg(精確到0.1mg),加入0.125gBHT,用二氯甲烷溶解,轉移至50mL棕色容量瓶中定容至刻度。
1.3.2 β-胡蘿卜素標準中間液(100 μg/mL)
從β-胡蘿卜素標準儲備液中準確移取10.0 mL溶液于50mL棕色容量瓶中,用二氯甲烷定容至刻度。
1.3.3 β-胡蘿卜素標準工作液
從β-胡蘿卜素標準中間液中分別準確移取0.50 mL、1.00 mL、2.00 mL、3.00 mL、4.00 mL、10.00 mL溶液至6個100 mL棕色容量瓶。 用二氯甲烷定容至刻度,得到濃度為0.5 μg/mL、1.0 μg/mL、2.0 μg/mL、3.0 μg/mL、4.0 μg/mL、10 μg/mL的系列標準工作液。
1.3.4 碘乙醇溶液(0.05 mol/L)
吸取5 mL碘溶液,用乙醇稀釋至50 mL,混勻。
1.3.5 異構化β-胡蘿卜素溶液
取10 mLβ-胡蘿卜素標準儲備液于燒杯中,加入20 μL碘乙醇溶液,搖勻后于日光下或距離40 W日光燈30 cm處照射15 min,用二氯甲烷稀釋至50 mL。搖勻后過0.45 μm濾膜,備HPLC色譜分析用。
1.4供試品溶液制備
1.4.1 預處理
精確稱取1g~5g (精確至0.001g)螺旋藻粉,轉至250mL錐形瓶中,加入1g抗壞血酸、75mL無水乙醇,于60℃±1℃水浴振蕩30min。
1.4.2 皂化
加入25mL氫氧化鉀溶液,蓋上瓶塞。置于已預熱至53℃±2℃恒溫振蕩水浴箱中,皂化30min。取出,靜置,冷卻到室溫。
1.4.3 試樣萃取
將皂化液轉入500mL分液漏斗中,加入100mL石油醚,輕輕搖動,排氣,蓋好瓶塞,室溫下振蕩,10min后靜置分層,將水相轉入另一分液漏斗中按上述方法進行第二次提取。合并有機相,用水洗至近中性。棄水相,有機相通過無水硫酸鈉過濾脫水。濾液收入500mL蒸發瓶中,于旋轉蒸發器上40℃±2℃減壓濃縮,近干。用氮氣吹干,用移液管準確加入5.0mL二氯甲烷,蓋上瓶塞,充分溶解提取物。經0.45 μm膜過濾后,棄出初始約1mL濾液后收集至進樣瓶中,備用。
1.5 色譜條件
a) 色譜柱:C30柱,柱長150mm,內徑4.6mm,粒徑5μm,或等效柱;
b) 流動相:A相:甲醇:乙腈:水=73.5:24.5:2;
B相:甲基叔丁基醚;
表5 梯度程序
|
時間 /min |
0 |
15 |
18 |
19 |
20 |
22 |
|
A% |
100 |
59 |
20 |
20 |
0 |
100 |
|
B% |
0 |
41 |
80 |
80 |
100 |
0 |
c) 流速:1.0mL/min;
d) 檢測波長:450nm;
e) 柱溫:30 ℃±1 ℃;
f) 進樣體積:20μL。
1.6 測定
在相同色譜條件下,將待測液注入液相色譜儀中,以保留時間定性,根據峰面積采用外標法定量,β-胡蘿卜素根據全反式β-胡蘿卜素響應因子進行計算。
1.7 全反式β-胡蘿卜素色譜純度的計算
1.7.1 β-胡蘿卜素異構體保留時間的確認
分別取β-胡蘿卜素標準中間液(100 μg/mL)和異構化β-胡蘿卜素溶液,按照色譜條件注入HPLC儀進行色譜分析。根據β-胡蘿卜素標準中間液的色譜圖確認全反式β-胡蘿卜素的保留時間;對比β-胡蘿卜素標準中間液和異構化β-胡蘿卜素溶液色譜圖中各峰面積變化,以及與全反式β-胡蘿卜素的位置關系確認順式β-胡蘿卜素異構體的保留時間:全反式β-胡蘿卜素前較大的色譜峰為13-順式-β-胡蘿卜素,緊鄰全反式β-胡蘿卜素后較大的色譜峰為9-順式-β-胡蘿卜素,13-順式-β-胡蘿卜素前是15-順式-β-胡蘿卜素,另外可能還有其他較小的順式結構色譜峰,色譜圖見圖。
1.7.2 全反式β反胡蘿卜素標準液色譜純度的計算
取β-胡蘿卜素標準工作液(3 μg/mL),按照色譜條件進行HPLC分析,重復進樣6次。計算全反式β-胡蘿卜素色譜峰的峰面積、全反式與上述各順式結構的峰面積總和,全反式β-胡蘿卜素色譜純度( CP )按公式計算。
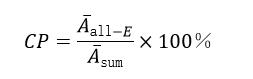
CP ———全反式β-胡蘿卜素色譜純度,%;
Ᾱ all-E ———全反式β-胡蘿卜素色譜峰峰面積平均值,單位為峰面積(AU);
Ᾱ sum ———全反式β-胡蘿卜素及各順式結構峰面積總和平均值,單位為峰面積(AU)。
1.8 結果計算
計算全反式β-胡蘿卜素響應因子
將β-胡蘿卜素混合標準工作液注入HPLC儀中(色譜圖見圖1),根據保留時間定性,測定β-胡蘿卜素各異構體峰面積。
β-胡蘿卜素根據標準工作液標定濃度、全反式β-胡蘿卜素6次測定峰面積平均值、全反式β-胡蘿卜素色譜純度( CP ),按公式計算全反式β-胡蘿卜素響應因子。
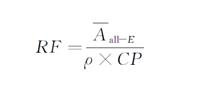
式中:
RF ———全反式β-胡蘿卜素響應因子,單位為峰面積毫升每微克(AU·mL/μg);
Ᾱ all-E ———全反式β-胡蘿卜素標準工作液色譜峰峰面積平均值,單位為峰面積(AU);
ρ ———β-胡蘿卜素標準工作液標定濃度,單位為微克每毫升(μg/mL);
CP ———全反式β-胡蘿卜素的色譜純度,%。
試樣中β-胡蘿卜素含量按下公式計算:
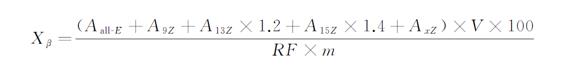
式中:
Xβ ———試樣中β-胡蘿卜素的含量,單位為微克每百克(μg/100g);
Aall-E ———試樣待測液中全反式β-胡蘿卜素峰面積,單位為峰面積(AU);
A9Z ———試樣待測液中9-順式-β-胡蘿卜素的峰面積,單位為峰面積(AU);
A13Z ———試樣待測液中13-順式-β-胡蘿卜素的峰面積,單位為峰面積(AU);
1.2 ———13-順式-β-胡蘿卜素的相對校正因子;
A15Z ———試樣待測液中15-順式-β-胡蘿卜素的峰面積,單位為峰面積(AU);
1.4 ———15-順式-β-胡蘿卜素的相對校正因子;
AxZ ———試樣待測液中其他順式β-胡蘿卜素的峰面積,單位為峰面積(AU);
V ———試樣液定容體積,單位為毫升(mL);
100 ———將結果表示為微克每百克(μg/100g)的系數;
RF ———全反式β-胡蘿卜素響應因子,單位為峰面積毫升每微克(AU·mL/μg);
m ———試樣質量,單位為克(g)。
注1:由于β-胡蘿卜素各異構體百分吸光系數不同(見附錄D),所以在β-胡蘿卜素計算過程中,需采用相對校正因子對結果進行校正。
注2:如果試樣中其他順式β-胡蘿卜素含量較低,可不進行計算。
1.9 色譜圖
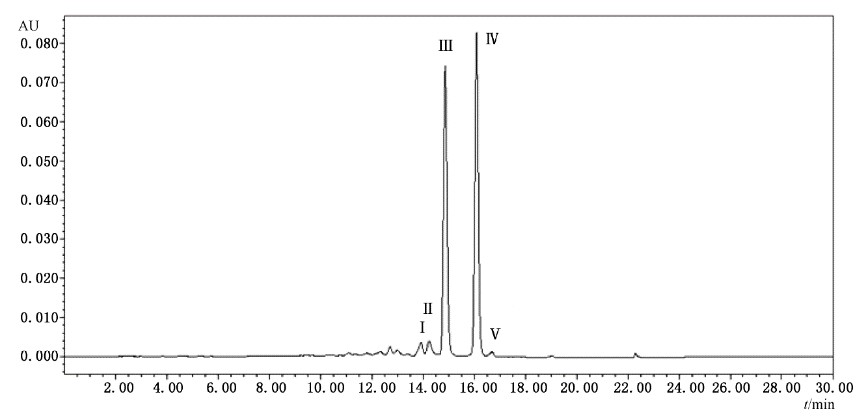
圖1 β-胡蘿卜素檢測色譜圖
說明:
Ⅰ——15-順式-β-胡蘿卜素;
Ⅱ——13-順式-β-胡蘿卜素;
Ⅲ——全反式α-胡蘿卜素;
Ⅳ——全反式β-胡蘿卜素;
Ⅴ——9-順式-β-胡蘿卜素。
2 藻藍蛋白的測定
2.1試劑
磷酸鹽緩沖溶液:將0.1 mol/L磷酸二氫鉀溶液與0.1 mol/L磷酸氫二鉀溶液(45+55V/V) 混合,溶液pH值為7.0。
2.2儀器和設備
2.2.1 分光光度計
2.2.2 超聲波振蕩器
2.2.3 離心機(3000 r/min)
2.2.4 低溫冰箱(-20 ℃)
2.2.5 離心管(50 mL)。
2.3 供試品溶液制備
稱取試樣0.25-0.5g(精確至0.0001g)。用緩沖液(2.1項)溶解,超聲振蕩5 min.定容于250 mL容量瓶中,搖勻。將溶液全部轉入250 mL廣口塑料瓶,置于-20℃冰箱內冷凍12h(或放置過夜)。取出解凍,搖勻。
2.4 測定
取部分溶液于離心管中,在3000r/min轉速下離心15min取上層清液.1 cm比色皿,在分光光度計上分別測定620 nm、652 nm、562 nm處的吸光度,用緩沖液(2.1項)做空白。
2.5 結果計算
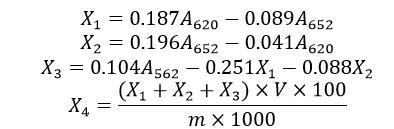
X1 ——測試液中藻藍素的含量,單位為毫克每毫升(mg/mL);
X2 ——測試液中異藻藍素的含量,單位為毫克每毫升(mg/mL);
X3 ——測試液中藻紅素的含量,單位為毫克每毫升(mg/mL);
A——相應波長處(620nm,652nm,562nm)測得吸光值;
X4 ——試樣中藻藍蛋白的質量分數,單位為克每100克(g/100g);
V——樣品定容體積,單位為毫升(mL)。
m——試樣質量,單位為克(g)。
測定結果取平行試驗結果的算術平均值,保留小數點后第二位。
平行試驗允許誤差(相對)不大于4%。
注2 整個操作過程須注意避光,分光光度測定應在15 min 內完成。
【儲存】包裝應密封、牢固、防潮、不易破損,貯藏在遮蔭、干燥、通風的庫房內
【產品的劑型】片劑、顆粒劑、硬膠囊
——————————
附件4
《保健食品原料目錄 魚油》
|
原料名稱 |
每日用量 |
功效 |
|||
|
名稱 |
用量范圍 |
適宜人群 |
不適宜人群 |
注意事項 |
|
|
魚油 |
不高于 4.0g (其中, EPA+DHA 的用量不低于 1.0g ) |
血脂偏高者 |
少年兒童、孕婦、乳母;出血傾向者和出血性疾病患者;肝功能不全者 |
對海產品過敏者不推薦食用 |
輔助降血脂 |
魚油原料技術要求
【來源】
可食用海洋魚經蒸煮、分離得粗魚油,再經進一步精制獲得用于生產保健食品的原料魚油,分為甘油三酯型魚油和乙酯型魚油。實際生產采用的工藝應包含但不僅限于以下環節:
① 甘油三酯型魚油生產工藝
粗魚油經脫酸、脫色等工藝處理后得到甘油三酯型魚油;或經乙酯化、蒸餾、甘油酯化等工藝處理后得到甘油三酯型魚油。
② 乙酯型魚油生產工藝
粗魚油經乙酯化、蒸餾等工藝處理后得到乙酯型魚油。
保健食品原料魚油可來源于魚油、魚油提取物、多烯魚油,技術要求應滿足本文本要求。
【感官要求】
應符合表1規定。
表1 感官指標
|
項目 |
要求 |
|
色澤 |
淺黃色或橙紅色 |
|
滋味、氣味 |
稍有魚油特有的腥味,無魚油酸敗味 |
|
狀態 |
澄清透明的液體,無沉淀物,無肉眼可見外來雜質 |
【理化指標】
應符合表2規定。
表2 理化指標
|
項目 |
指標 |
檢測方法 |
|
水分及揮發物, % ≤ |
0.2 |
GB 5009.236 |
|
酸價(以 KOH 計), mg/g ≤ |
3.0 |
GB 5009.229 |
|
過氧化值, mmol/kg ≤ |
5.0 |
GB 5009.227 |
|
茴香胺值 ≤ |
20.0 |
GB/T 24304 |
|
碘值, g/100 g ≥ |
140 |
GB/T 5532 |
|
不皂化物, % ≤ |
3.0 |
GB/T 5535.2 |
|
鉛(以 Pb 計), mg/kg ≤ |
0.1 |
GB5009.12 |
|
總砷(以 As 計), mg/kg ≤ |
0.1 |
GB5009.11 |
|
苯并 [a] 芘, μg/kg ≤ |
10 |
GB5009.27 |
【標志性成分指標】
應符合表4規定。
表4標志性成分指標
|
項目 |
指標 |
檢測方法 |
|
EPA+DHA 含量, g/100g |
≥25 |
GB 5009.168 《食品安全國家標準 食品中脂肪酸的測定》 |
【儲存】干燥陰涼、避光、密封保存。
【產品的劑型】軟膠囊
——————————
附件5
《保健食品原料目錄 褪黑素》
|
原料名稱 |
每日用量 |
功效 |
|||
|
名稱 |
用量范圍 |
適宜人群 |
不適宜人群 |
注意事項 |
|
|
褪黑素 |
1-3mg |
成人 |
少年兒童、孕婦、乳母 |
從事駕駛、機械作業或危險操作者,不要在操作前或操作中食用。自身免疫癥(類風濕等)及甲亢患者慎用。 |
改善睡眠 |
褪黑素原料技術要求
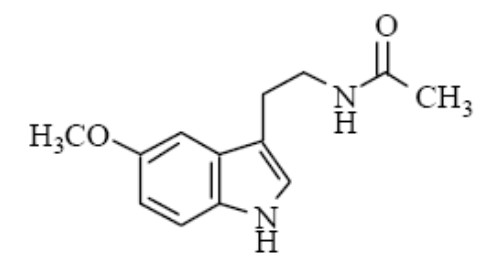
【來源】
褪黑素原料是以合成的5-甲氧基色胺經過乙酰化制得。化合物名稱為N-乙酰基-5-甲氧基色胺,分子式為C13H16N2O2 。
【感官要求】
應符合表1規定。
表1 感官指標
|
項目 |
要求 |
|
色澤 |
白色或類白色 |
|
狀態 |
結晶狀顆粒或粉末 |
【鑒別】
在【標志性成分指標】項下記錄的色譜圖中,供試品溶液主峰的保留時間應與對照品溶液主峰的保留時間一致。
【理化指標】
應符合表2規定。
表2 理化指標
|
項目 |
指標 |
檢驗方法 |
|
5- 甲氧基色胺, % ≤ |
0.1 |
1 5- 甲氧基色胺的測定 |
|
干燥失重, % ≤ |
0.5 |
2 干燥失重的測定 |
|
熾灼殘渣, % ≤ |
0.1 |
3 熾灼殘渣的測定 |
|
鉛(以 Pb 計), mg/kg ≤ |
2.0 |
GB 5009.12 |
|
總砷(以 As 計), mg/kg ≤ |
1.0 |
GB 5009.11 |
|
總汞(以 Hg 計), mg/kg ≤ |
0.3 |
GB 5009.17 |
1 5-甲氧基色胺的測定
1.1 試劑和材料
1.1.1 5-甲氧基色胺標準物質
1.1.2 甲醇溶液:70 %
1.1.3 甲醇:色譜純
1.1.4 三氟乙酸:分析純
1.2 儀器和設備
1.2.1 電子天平
1.2.2 超聲清洗器
1.2.3 高效液相色譜儀
1.3 對照品溶液的制備
精密稱定5- 甲氧基色胺約 50mg ,置 50mL 量瓶中,加 70% 甲醇溶液溶解并稀釋至刻度,搖勻。精密量取適量上述溶液,用流動相定量稀釋制成每 1 mL 中含 1 μg 的溶液,作為對照品溶液。
1.4供試品溶液的制備
精密稱定褪黑素原料約 100 mg ,置于 10 mL 量瓶中,加 70 % 甲醇溶液溶解并稀釋至刻度,搖勻。精密量取適量上述溶液,用流動相定量稀釋制成每 1 mL 中含 1 mg 的溶液,作為供試品溶液。
1.5測定
色譜條件與測定方法 用十八烷基硅烷鍵合硅膠為填充劑;色譜柱規格: 4.6 mm×150 mm , 5 μm ;流動相為甲醇: 0.1% 三氟乙酸水溶液 =35:65 。檢測波長: 222 nm ;流速 :1.0 mL/min ;進樣量: 10 μL 。將上述溶液依次注入高效液相色譜儀,記錄色譜圖。以保留時間定性,分別測量對照品和供試品溶液峰面積。
1.6 結果計算
5- 甲氧基色胺含量計算 :
W = (Au / As)×(cs ×V / m)/1000×100%
式中:
W : 5- 甲氧基色胺含量, % ;
Au :供試品溶液的峰面積;
As :標準品溶液的峰面積;
m :原料的稱樣量( mg );
V :總體積( mL );
cs :標準品溶液的濃度( μg/mL )。
2 干燥失重的測定
2.1 試劑和材料
干燥劑:五氧化二磷、無水氯化鈣或硅膠。
2.2 儀器和設備
2.2.1 電子天平
2.2.2 扁形稱量瓶
2.2.3 烘箱
2.2.4 干燥器
2.3 分析步驟
取潔凈鋁制或玻璃制的扁形稱量瓶,置于 101 ℃-105 ℃ 烘箱中,瓶蓋置于瓶邊,加熱 1.0 h ,取出蓋好,置干燥器內冷卻,稱量,重復干燥 1 h 以上,至前后兩次質量差不超過 0.3 mg ,即為恒重。精密稱取 1 g 試樣,放入此稱量瓶中,試樣厚度不超過 5 mm ,加蓋,精密稱量后,置于 101 ℃-105 ℃ 干燥箱中,瓶蓋置于瓶邊,干燥 2 h-4 h 后,蓋好取出,放入干燥器內冷卻 0.5 h 后稱量。重復以上操作干燥 1 h 以上,至前后兩次質量差不超過 0.3 mg 。
2.4 結果計算
干燥失重的計算 :
X= ( m1-m2 ) / ( m1-m3 ) ×100%
式中:
X :干燥失重( % );
m1 :稱量瓶和試樣的質量( g );
m2 :稱量瓶和試樣干燥恒重后的質量( g );
m3 :稱量瓶干燥恒重后的質量( g )。
3 熾灼殘渣的測定
3.1 試劑和材料
3.1.1 硫酸,分析純
3.1.2 干燥劑:五氧化二磷、無水氯化鈣或硅膠
3.2 儀器和設備
3.2.1 電子天平
3.2.2 坩堝
3.2.3 電熱板
3.2.4 馬弗爐
3.2.5 干燥器
3.3 分析步驟
將洗凈的坩堝置于馬弗爐內,在 700 ℃-800 ℃ 下熾灼 30 min 以上,后在干燥器內冷卻至室溫,稱重,精確至 0.0001g 。重復熾灼 30 min 以上,至前后兩次質量差不超過 0.3 mg ,即為恒重。稱取 1 g-2 g 試樣放入此坩堝中,加蓋,精密稱量后,將其蓋半掩置于電熱板上,以小火加熱使試樣充分炭化至無煙,放冷,加硫酸 0.5-1 mL 使濕潤,低溫加熱至硫酸蒸汽除盡后, 700 ℃-800 ℃ 下熾灼 1 h 以上,使完全灰化,置干燥器內,放冷,精密稱定。重復熾灼 30 min 以上,至前后兩次質量差不超過 0.3 mg 。
3.4 結果計算
熾灼殘渣計算 :
X= ( m1-m2 ) / ( m3-m2 ) ×100%
式中:
X :熾灼殘渣( % );
m1 :坩堝和灰分恒重后的質量( g );
m2 :坩堝恒重后的質量( g );
m3 :坩堝和試樣的質量( g )。
【微生物指標】
應符合表3規定。
表3 微生物指標
|
項目 |
指標 |
檢驗方法 |
|
菌落總數, CFU/g ≤ |
1000 |
GB 4789.2 |
|
霉菌和酵母, CFU/g ≤ |
50 |
GB 4789.15 |
|
大腸菌群, MPN/g ≤ |
0.92 |
GB 4789.3 MPN 計數法 |
|
沙門氏菌 ≤ |
0/25g |
GB 4789.4 |
|
金黃色葡萄球菌 ≤ |
0/25g |
GB 4789.10 |
【標志性成分指標】
應符合表4規定。
表4標志性成分指標
|
項目 |
指標 |
檢驗方法 |
|
褪黑素含量, % ≥ |
99.5 |
4 褪黑素的含量測定 |
4 褪黑素的含量測定
4.1 試劑和材料
4.1.1 褪黑素標準物質
4.1.2 甲醇溶液:70 %
4.1.3 甲醇:色譜純
4.1.4 三氟乙酸:分析純
4.2 儀器和設備
4.2.1 電子天平
4.2.2 超聲清洗器
4.2.3 高效液相色譜儀
4.3 供試品溶液的制備
精密稱定褪黑素原料約100 mg,置于100 mL量瓶中,加70 %甲醇溶液溶解并稀釋至刻度,搖勻。精密量取適量上述溶液,用流動相定量稀釋制成每1 mL中含0.1mg的溶液,作為供試品溶液。
4.4 對照品溶液的制備
精密稱定褪黑素標準物質約50 mg,置于50 mL量瓶中,加70 %甲醇溶液溶解并稀釋至刻度,搖勻。精密量取適量上述溶液,用流動相定量稀釋制成每1mL中含0.1mg的溶液,作為對照品溶液。
4.5 測定
色譜條件與測定方法 用十八烷基硅烷鍵合硅膠為填充劑;色譜柱規格:4.6 mm×150 mm,5 μm;流動相為甲醇:0.1%三氟乙酸水溶液=35:65。檢測波長:222 nm;流速:1.0 mL/min;進樣量:10μL。將上述溶液依次注入高效液相色譜儀,記錄色譜圖。以保留時間定性,分別測量對照品和供試品溶液峰面積。
4.6 結果計算
褪黑素含量計算 :
W = (Au / As)×(cs×V / m)×100%
式中:
W :褪黑素含量, % ;
Au :供試品溶液的峰面積;
As :標準品溶液的峰面積;
m :原料的稱樣量( mg );
V :總體積( mL );
cs :標準品溶液的濃度( mg/mL )。
【儲存】避光、密閉,在陰涼處保存
【產品的劑型】片劑、顆粒劑、硬膠囊、軟膠囊
【其他】
產品配方中除褪黑素和必要的輔料(賦形劑)外,不得添加其他成分(維生素B6除外)
——————————
