嬰幼兒配方乳粉中恰當的益生菌添加,對于培育嬰兒健康的腸道微生態具有積極作用。它不僅有助于構筑穩固的益菌群,還能夠有效抑制致病菌的增長,進而使嬰兒的腸道菌群結構更趨向于母乳喂養下的理想狀態。
添加益生菌種的配方在進行嬰幼兒配方乳粉注冊時,需滿足哪些要求呢?為幫助企業全面了解,瑞旭集團結合嬰配法規及問答要求進行相關分析。
一、嬰配奶粉可用菌種的要求是什么?
如果生產企業在嬰幼兒配方食品中添加菌種,產品中的活菌數應≥106 CFU/g(mL)。同時,菌種(菌株號)應符合原衛生部、原國家衛生計生委、國家衛生健康委發布的允許用于嬰幼兒食品的菌種名單,詳見下表1:
表1:可用于嬰幼兒食品的菌種名單
菌種名稱 | 拉丁學名 | 菌株號 |
嗜酸乳桿菌* | Lactobacillus acidophilus | NCFM |
動物雙歧桿菌乳亞種 | Bifidobacterium animalis subsp. lactis | Bb-12 |
HN019 | ||
Bi-07 | ||
鼠李糖乳酪桿菌 | Lacticaseibacillus rhamnosus | GG |
鼠李糖乳酪桿菌 | Lacticaseibacillus rhamnosus | HN001 |
羅伊氏粘液乳桿菌 | Limosilactobacillus reuteri | DSM17938 |
發酵粘液乳桿菌 | Limosilactobacillus fermentum | CECT5716 |
短雙歧桿菌 | Bifidobacterium breve | M-16V |
瑞士乳桿菌 | Lactobacillus helveticus | R0052 |
長雙岐桿菌嬰兒亞種 | Bifidobacterium longum.subsp. infantis | R0033 |
兩歧雙歧桿菌 | Bifidobacterium bifidum | R0071 |
鼠李糖乳酪桿菌 | Lacticaseibacillus rhamnosus | MP108 |
長雙歧桿菌長亞種 BB536 | Bifidobacterium longum subsp. longum BB536 | BB536 |
*僅限用于1歲以上幼兒的食品。
活性菌在研發過程中的試驗要求
1. 均勻性工藝驗證
樣品均勻性分析指標至少包括必需成分中的宏量營養素、維生素、礦物質,可選擇成分及其他不易混勻的成分。每類指標中應選擇添加量較小的、不易混勻的成分(如活性菌、乳鐵蛋白)。
2. 產品穩定性研究
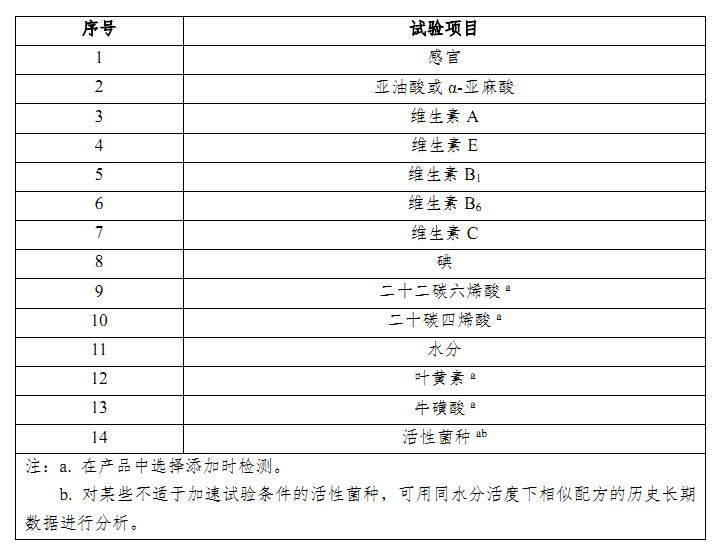
根據《嬰幼兒配方乳粉產品穩定性研究指南(試行)》,應選取在產品保質期內易于變化、可能影響產品質量、安全性、營養充足性的項目作為重點試驗項目,重點試驗項目至少包括附錄(詳見下表2)中的項目。
活性菌一般在配方組成中用量較小,嬰配奶粉產品穩定性分析指標應包含活性菌種。而對于某些不適于加速試驗條件的活性菌種,可用同水分活度下相似配方的歷史長期數據進行分析。可以理解為,如果按新國標調整前后的配方添加的活性菌相同,且水分活度無明顯差異時,可以使用調整前同一申請人已獲注冊配方的歷史長期數據進行分析。
表2:穩定性重點試驗項目
三、注冊前應注意哪些要點:
1. 新國標注冊類型
已獲注冊的產品配方增加或去除可選擇成分的,按注銷原配方申請新配方注冊辦理。其中,涉及膳食纖維(包括低聚果糖、低聚半乳糖、多聚果糖、棉子糖、聚葡萄糖、酵母β-葡聚糖等)、核苷酸以及可用于嬰幼兒食品的菌種等三類原料的,僅當添加或去除某一類原料時(不包括同一類別內原料品種調整),按注銷原配方申請新配方注冊辦理。
2. 配方明顯差異性
明顯差異是指營養特征而非營養成分品種,產品配方及其差異性的基礎應為母乳研究、營養學研究成果。當同一申請人在相同年齡段配方之間添加的活性菌品種和(或)量不同時,不構成明顯差異。可以理解為,兩配方之間僅一方添加益生菌這一類原料才屬于明顯差異。
四、新國標申報應提供哪些相關資料?
1. 提供菌株原料的來源說明;
2. 提供菌株鑒定報告,報告應滿足以下要求:
- 鑒定報告可由申請人或供應商提供;
- 鑒定報告應鑒定到株水平;
- 菌株鑒定應在申請日前兩年內完成。
3. 提供因使用菌株可能引起產品雜菌污染的防控措施,應至少包含以下內容:
- 活性菌原料的質量規格和檢測報告:提供活性菌原料的質量規格、衛生學指標及相應的檢測報告,包括但不限于菌株組成、計數、化學及微生物污染等指標;
- 活性菌原料管理:對供應商選擇、進貨查驗程序(包括但不限于各種質量規格及衛生學指標)、原料儲運條件、出入庫管理等有明確要求;
- 成品生產相關過程控制:保證生產過程中的菌株一致性,提供使用活性菌原料的關鍵工序及清場等環節的控制措施;
- 成品中相關項目檢測等措施:對成品中的活性菌計數及微生物污染指標進行批批檢測。如使用的是厭氧的活性菌(如雙歧桿菌),產品檢驗報告中應包括菌落總數的項目。
4. 申請材料簡化:
同一申請人不同配方的申請材料中,各配方使用的菌株相同、原料組成相同且供應商相同的,按新國標申請注冊時,菌株溯源、雜菌污染防控等相關材料可以簡化。也就是說,可在某一配方的申請材料中提供完整內容,其他配方中提供一致性說明即可。
若您對嬰配奶粉境內外生產企業新國標注冊有任何疑問或需要任何幫助,歡迎致電聯系瑞旭集團食品事業部:0571-87206538。
了解更多嬰配相關知識,可關注公眾號【CIRS 食品合規互動】。

