作為國際公認的一類重量級營養元素,2023年,我國實現了母乳低聚糖(HMOs)在法規上的突破:2’-巖藻糖基乳糖(2’-FL)和乳糖-N-新四糖(LNnT)正式被批準為食品營養強化劑新品種。之后,仍有多個HMOs走在合規道路中:2024年5月10日,CFSA最新發布的公開征求意見稿中,又出現了2’-FL和LNnT的身影。
中國HMOs法規進程加快、申報熱度持續高漲
HMOs的主要幾類物質在中國均有合規進度,其中2’-FL熱度最高。為幫助各企業掌握其最新進度,瑞旭集團特對2’-FL在我國的報批情況進行匯總。截止2024年5月10日:
- 已獲批的2’-FL(4款):微生物發酵法,標準相同、生產菌信息各不同;
- 已公開征求意見、尚未獲批的2’-FL(5款):包括1款合成法和4款微生物發酵法,除生產菌信息外執行公告,其中最新征求意見的1款產品生產菌信息與已獲批公告完全一致;
- 已受理、尚在技術審評中的2’-FL(12款):包括7款延期1款受理4款不予行政許可產品。
詳細信息請參見下文:
|
營養強化劑 |
來源 |
供體 |
公告 |
|
2’-巖藻糖基乳糖 2’-fucosyllactose |
大腸桿菌 K-12 DH1 MDO E. coli K-12 DH1 MDO |
螺桿菌 (Helicobacter spp.) a |
2023年10月7日 |
|
大腸桿菌K-12 MG1655 E. coli K-12 MG1655 |
螺桿菌 (Helicobacter spp.) a |
||
|
大腸桿菌 BL21(DE3) E. coli BL21(DE3) |
奈瑟菌 (Neisseria spp.) a |
||
|
大腸桿菌 BL21(DE3) Escherichia coli BL21(DE3) |
幽門螺桿菌 (Helicobacter pylori) a |
2024年3月13日2024年 第2號 |
a為α-1,2-巖藻糖基轉移酶供體
公開征求意見的2’-FL(5款)
|
序號 |
公開征求時間 |
備注 |
|
1 |
2021年10月21日 |
合成法 |
|
2 |
2023年08月23日 |
微生物發酵法。生產菌信息: 來源:谷氨酸棒狀桿菌 ATCC 13032; 供體:鹽漬假桿菌(Pseudopedobacter saltans)a |
|
3 |
2024年03月13日 |
微生物發酵法。生產菌信息: 來源:大腸桿菌BL21 star(DE3); 供體:大腸桿菌O126 a |
|
4 |
2024年05月10日 |
微生物發酵法。生產菌信息: 來源:大腸桿菌K-12 GI724; 供體:普通擬桿菌(Bacteroides vulgatus) a |
|
5 |
2024年05月10日 |
微生物發酵法。生產菌信息: 來源:大腸桿菌K-12 MG1655; 供體:螺桿菌(Helicobacter spp.) a 注:與2023年第8號生產菌公告信息一致 |
a為α-1,2-巖藻糖基轉移酶供體
處于受理及資料補充階段2’-FL(共12款)
|
序號 |
受理信息(時間/受理編號) |
審評信息/狀態 |
|
1 |
2023/07/14 衛食添新申字(2023)第0045號 |
2024/03/07 延期通知書信息送達 |
|
2 |
2023/09/20 衛食添新申字(2023)第0061號 |
2024/04/15 延期通知書信息送達 |
|
3 |
2023/11/01 衛食添新申字(2023)第0065號 |
|
|
4 |
2023/11/21 衛食添新申字(2023)第0074號 |
2023/12/12 延期通知書信息送達 |
|
5 |
2024/01/11 衛食添新申字(2024)第0002號 |
2024/04/15 延期通知書信息送達 |
|
6 |
2024/01/16 衛食添新申字(2024)第0005號 |
2024/02/08 延期通知書信息送達 |
|
7 |
2024/01/18 衛食添新申字(2024)第0009號 |
2024/02/08 延期通知書信息送達 |
|
8 |
2021/05/07 衛食添新申字(2024)第0042號 |
/ |
|
9 |
2023/11/30 衛食添新申字(2023)第0076號 |
2024/02/08 不予行政許可 |
|
10 |
2023/11/01 衛食添新申字(2023)第0064號 |
2024/02/08 不予行政許可 |
|
11 |
2023/09/19 衛食添新申字(2023)第0058號 |
2024/02/08 不予行政許可 |
|
12 |
2022/11/15 衛食添新申字(2022)第0085號 |
2024/03/25 不予行政許可 |
數據源于衛健委政務大廳信息公示欄
由上統計可以看出:2023年2’-FL正式獲批后,很多企業還是不斷提交新的申請并被受理,申報熱情高漲。其實不僅僅是2’-FL,HMOs中的其他幾類典型物質都有不僅一次的受理記錄。
即使產品信息符合獲批公告,也需要當做“新品種”申報。
相信很多企業和相關人士會產生疑問:為何它們會有如此多的報批申請呢?符合公告的產品還需要再次申報嗎?答案是:【需要的】。接下來,瑞旭集團會從兩方面展開分析。
食用安全
國際上已批準使用的、包括我國目前獲批的HMOs主要采用基因工程菌發酵制備。在中國該類添加劑新品種申報流程較為復雜,需要經過兩個監管部門的評估或審批。
(1)農業農村部,負責生產添加劑的工程菌的安全性評估工作;
(2)國家衛健委,負責發酵終產品,即食品添加劑新品種的審批工作。
對于轉基因微生物(即生產菌),可能其來源、供體與公告一致,但各企業的基因工程技術操作、產物合成途徑不可能完全相同,因此從食品安全角度和其工藝的特殊性,這類物質都需要農業農村部和國家衛健委的“個案審批”。
公告法規
以2’-FL的公告和最新公開征求意見稿內容為例,值得關注的有兩處:
- 生產菌需要經過安全性評估(瑞旭說明:僅滿足公告不行,仍需通過相關監管部門的評估)。

(圖源2023年 第8號公告)
- 最新發布的2’-FL公開征求意見稿中,生產菌信息完全符合之前的公告。(瑞旭說明:即使生產菌符合公告且通過安全性評估,仍需進行添加劑申報、并向公眾發布征求意見稿)
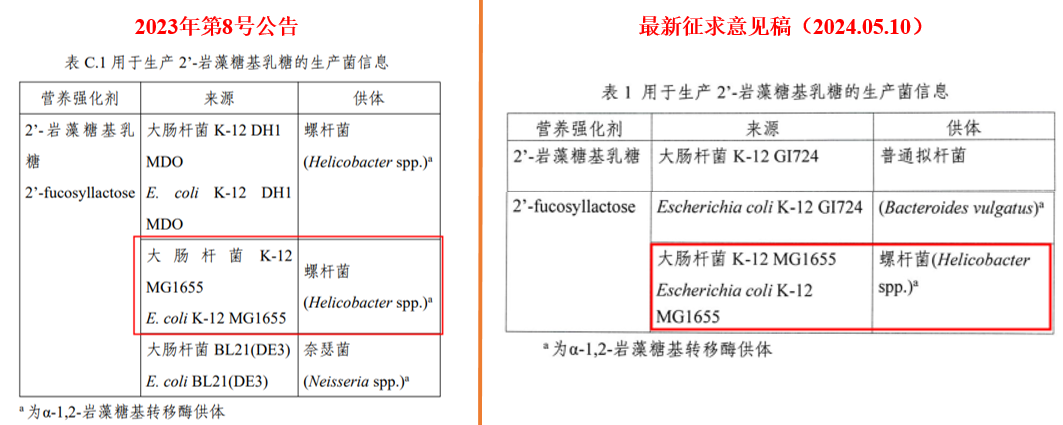
同時,瑞旭集團與監管部門和多方專家確認,對于利用合成生物技術生產的食品配料,如HMOs物質:即使生產菌信息能夠滿足公告要求,仍需通過農業農村部對生產菌的安全性評估、并且向衛健委提請食品添加劑新品種的申報審評。
此外,提醒此類原料的使用方,合規采購有資質的原料是保證終產品安全的重要因素。
HMOs一經合規,在中國應用市場勢頭正旺,相信未來幾年內會維持法規申報獲批和營養創新研發領域的熱度。瑞旭集團會一直關注這類物質的審批動態和政策變化!
關于瑞旭
瑞旭集團食品事業部組建于2012年,已經幫助超過1000家國內外食品及相關企業完成“一站式”的食品合規工作。在三新食品、合成生物學食品、美國GRAS、保健食品、兩特食品等申報領域擁有眾多成功案例。目前,瑞旭集團已代理數十款轉基因微生物食品添加劑申報,項目經驗按成功案例位于行業前列。歡迎垂詢或拜訪進一步了解我們的技術實力!
