為加快推進高端醫療裝備發展應用,工業和信息化部、國家衛生健康委聯合起草了《高端醫療裝備應用示范基地管理辦法(試行)》(征求意見稿),現面向社會公開征求意見。如有意見或建議,請于2022年8月10日前通過傳真或電子郵件反饋。
聯系方式:
工業和信息化部(裝備工業一司)010-68205603
國家衛生健康委(規劃司)010-68791230
傳真:010-66013726
電子郵箱:shewzh@miit.gov.cn
附件:《高端醫療裝備應用示范基地管理辦法(試行)》(征求意見稿)
工業和信息化部裝備工業一司
國家衛生健康委規劃司
2022年7月8日
【附件】
高端醫療裝備應用示范基地管理辦法(試行)
(征求意見稿)
第一章 總 則
第一條 為貫徹落實習近平總書記關于加快補齊我國高端醫療裝備短板的重要指示精神,按照全國評比達標表彰工作協調小組辦公室《關于公布第二批全國創建示范活動保留項目目錄的通告》要求,根據《“十四五”醫療裝備產業發展規劃》重點任務部署,推動醫療裝備產業高質量發展,指導各地科學有序開展高端醫療裝備應用示范基地(以下簡稱示范基地)建設,制定本辦法。
第二條 本辦法所稱高端醫療裝備是指產品性能達到國際先進或國內領先水平的醫療裝備,產品類別主要包括診斷檢驗裝備、治療裝備、監護與生命支持裝備、中醫診療裝備、婦幼健康裝備、保健康復裝備、有源植介入器械等。
第三條 本辦法所稱示范基地是指以醫療裝備作為優勢產業,對醫療裝備技術、產品、臨床應用、服務模式及創新鏈、產業鏈、服務鏈優化升級具有示范帶動作用,主導產品發展水平、規模效益、臨床應用等居行業領先地位的醫療裝備產業發展集聚區。
第四條 示范基地包括開展臨床應用示范和示范基地建設兩個部分,臨床應用示范是示范基地建設的組成部分和前提條件。
臨床應用示范,由知名醫療機構牽頭會同區域內醫療資源,與龍頭生產企業等合作開展新型產品診療技術及綜合外科復合手術室解決方案研究,探索可復制、可推廣的醫產合作新模式,對推動創新醫療裝備發展應用具有較強的示范帶動作用。
示范基地建設,由地方政府牽頭組織知名醫療機構、科研機構、生產企業、檢測機構等合作,探索建立健全醫療裝備從技術開發、產品生產、示范驗證到應用推廣的創新體系,營造包括政策、金融、監管、學科交叉、醫療示范等于一體的激勵產業創新發展的生態環境,形成主導產品特色鮮明、創新要素高度集聚、網絡協作緊密高效、產業生態體系完善的醫療裝備制造業集聚區。
第五條 工業和信息化部、國家衛生健康委負責示范基地的評審及相關管理工作。省級工業和信息化主管部門會同同級衛生健康主管部門負責組織本地區示范基地的申報、初審、推薦和日常監督管理等工作,并配合工業和信息化部、國家衛生健康委指導各地規范開展臨床應用示范、示范基地建設。
第二章 申報與評審
第六條 申報主體。
(一)臨床應用示范由醫療機構牽頭,采取“1+N+N”聯合體方式申報,即 1 家牽頭醫療機構+N 家醫療裝備企業+N家聯合醫療機構。
(二)示范基地建設由地方政府(地市級及以下,含產業園區、經濟技術開發區、高新技術開發區等)牽頭申報,組織醫療機構、醫療裝備企業、科研機構等開展合作。
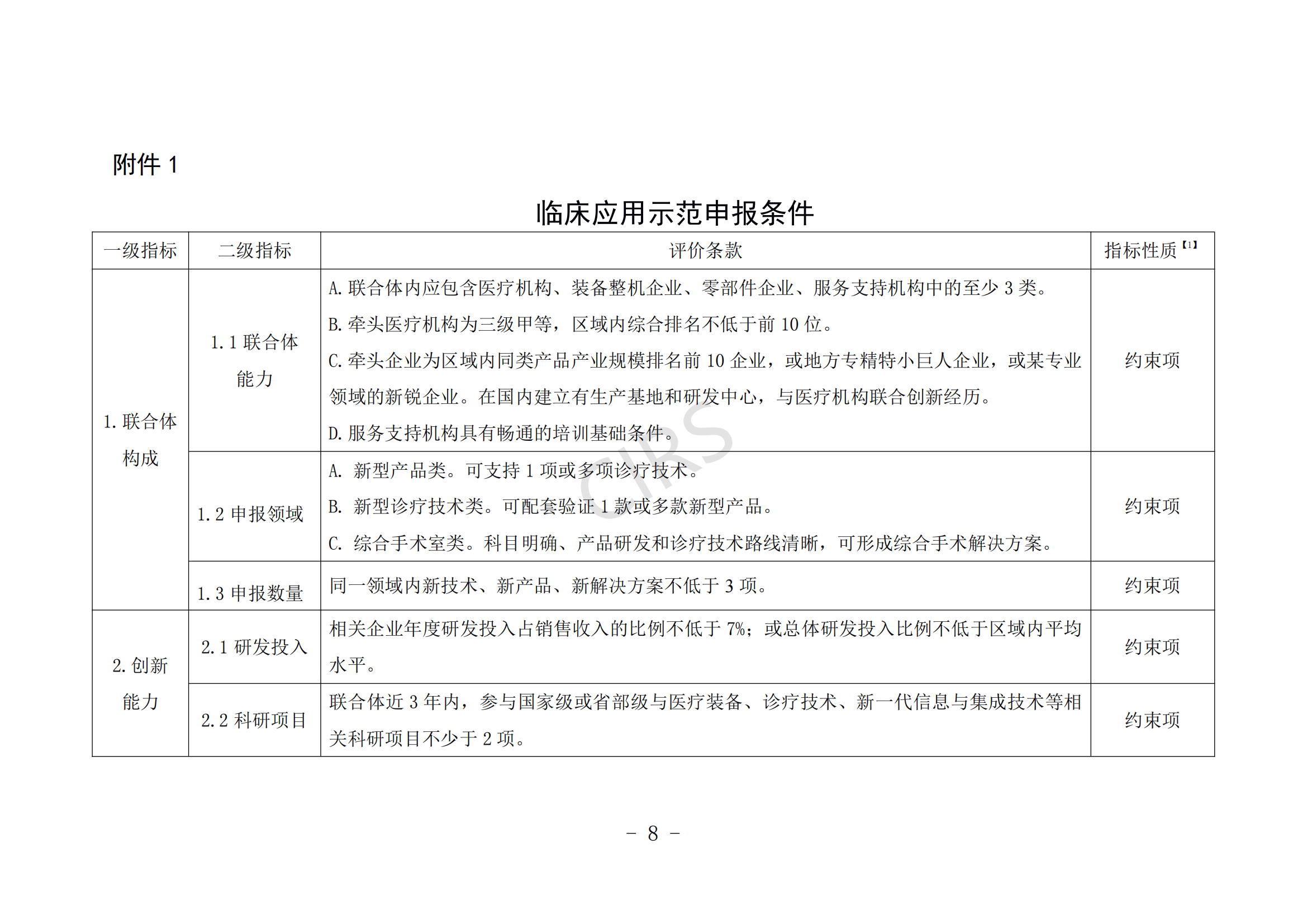
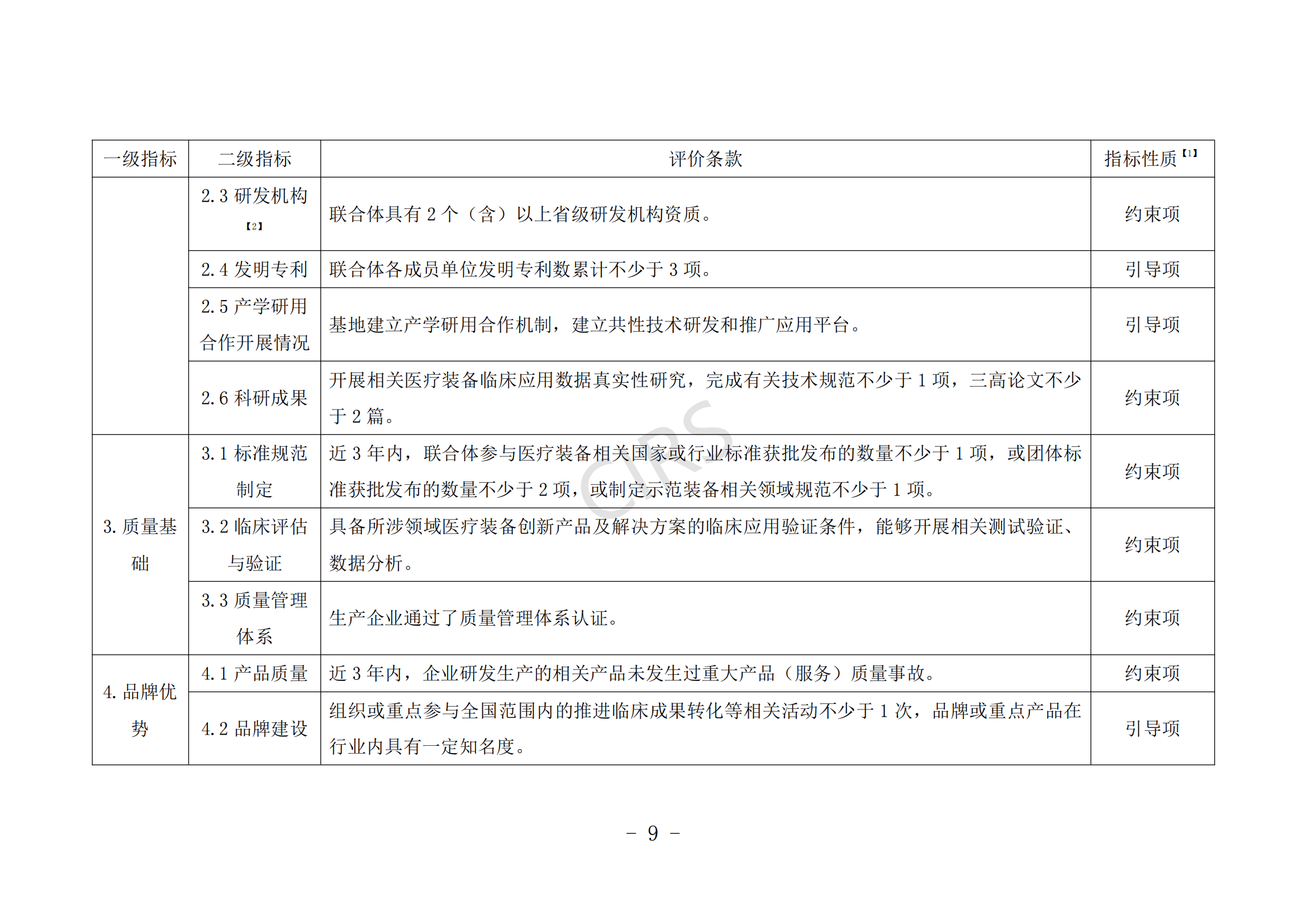
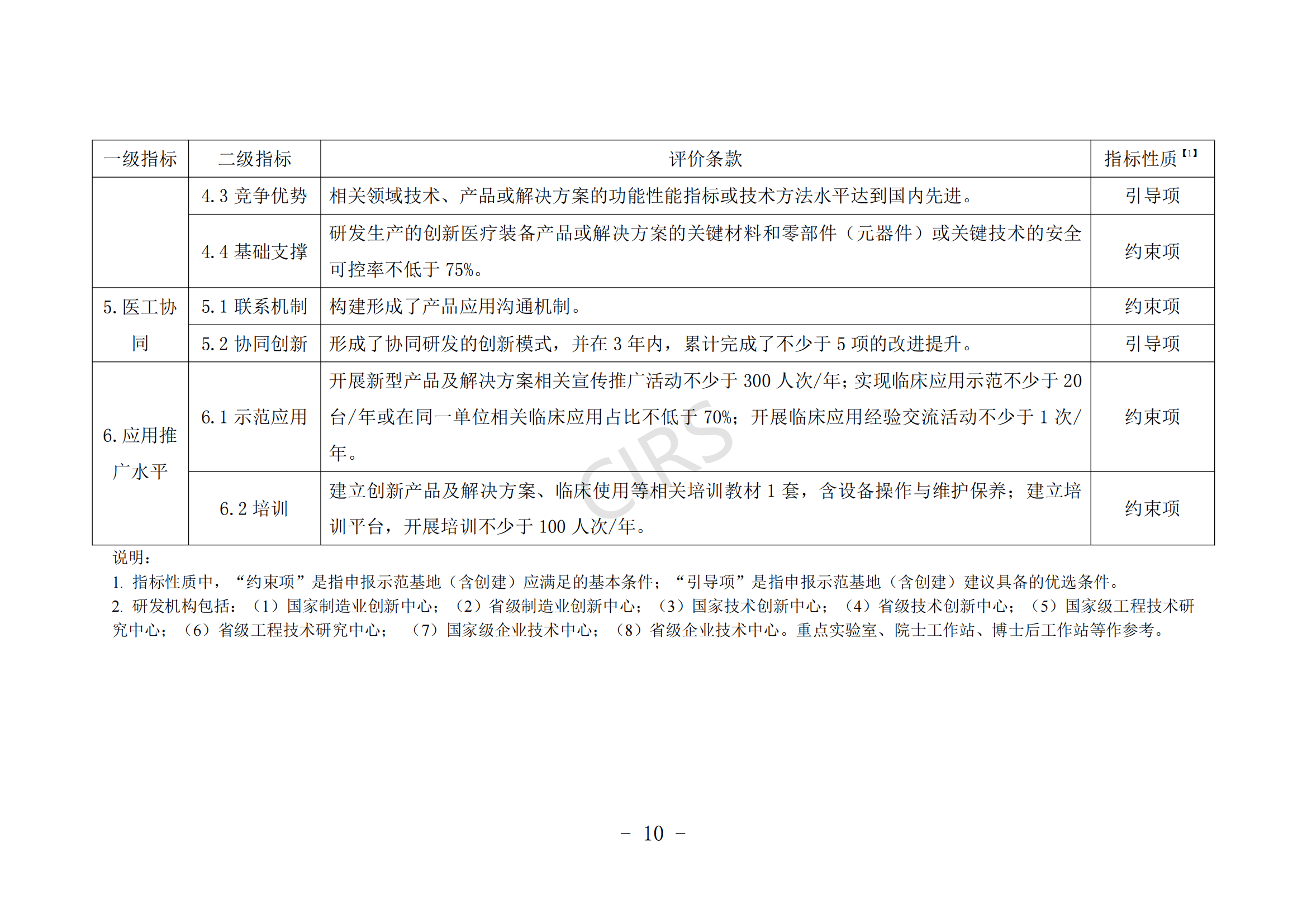
第七條 臨床應用示范申報條件。
(一)申報單位具備一定的基礎實力,擁有較強的行業引領地位。
(二)聯合體具備較強的創新醫療裝備研發生產、檢驗驗證、改進優化、臨床評價、推廣應用、知識產權保護運用等能力。
(三)聯合體具有較為完善的臨床研究管理體系和臨床研究資金保障。
(四)創新醫療裝備產品或解決方案的關鍵材料、零部件(元器件)、關鍵技術基本安全可控。
(五)所申報領域的醫療裝備產品或解決方案在申報單位臨床應用數量占有一定比例,且應符合《醫療器械監督管理條例》《醫療技術臨床應用管理辦法》等有關規定要求。
(六)近 3 年內未發生過重大產品(服務)質量事故。
申報條件具體要求見附件 1。
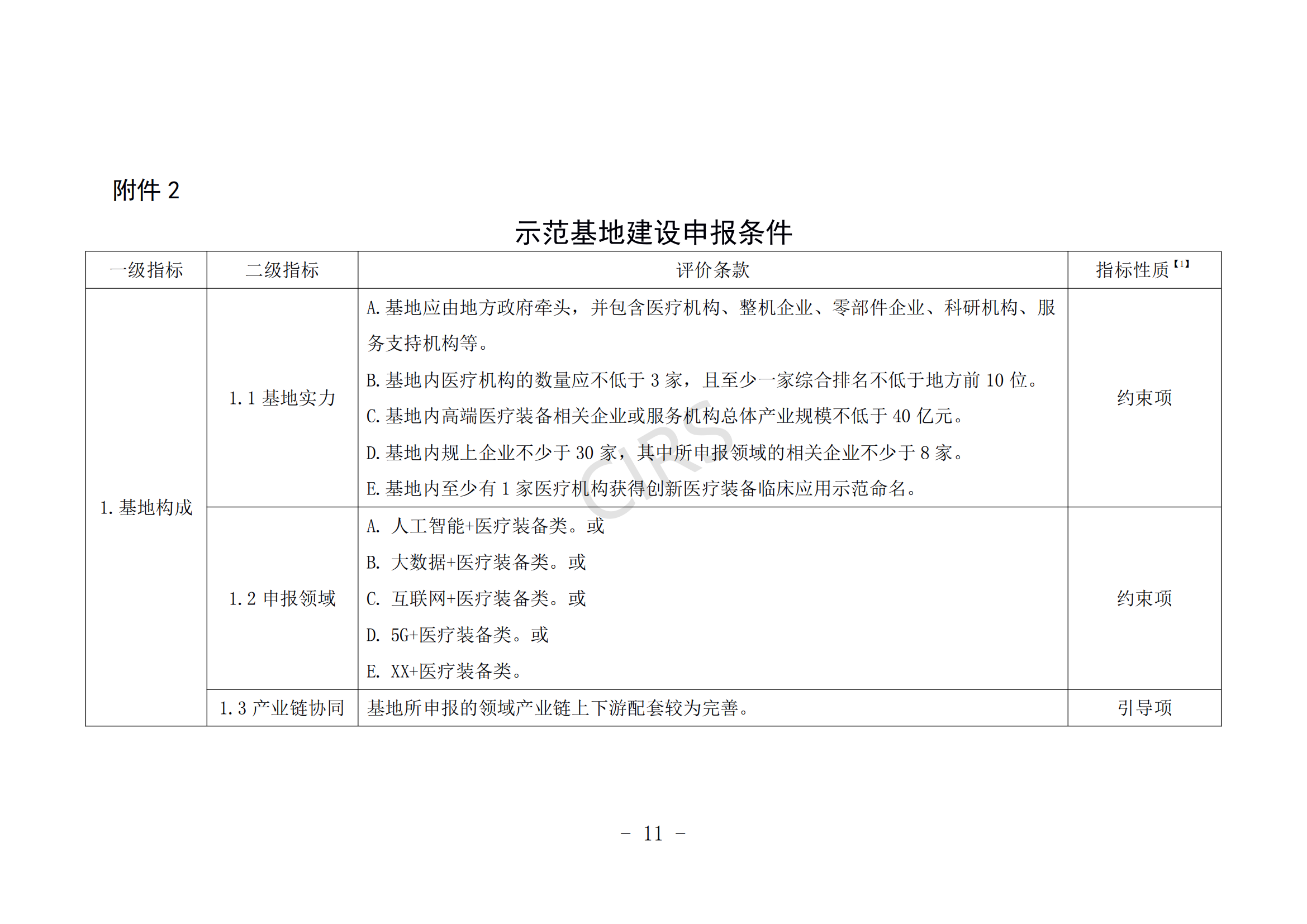
第八條 示范基地建設申報條件。
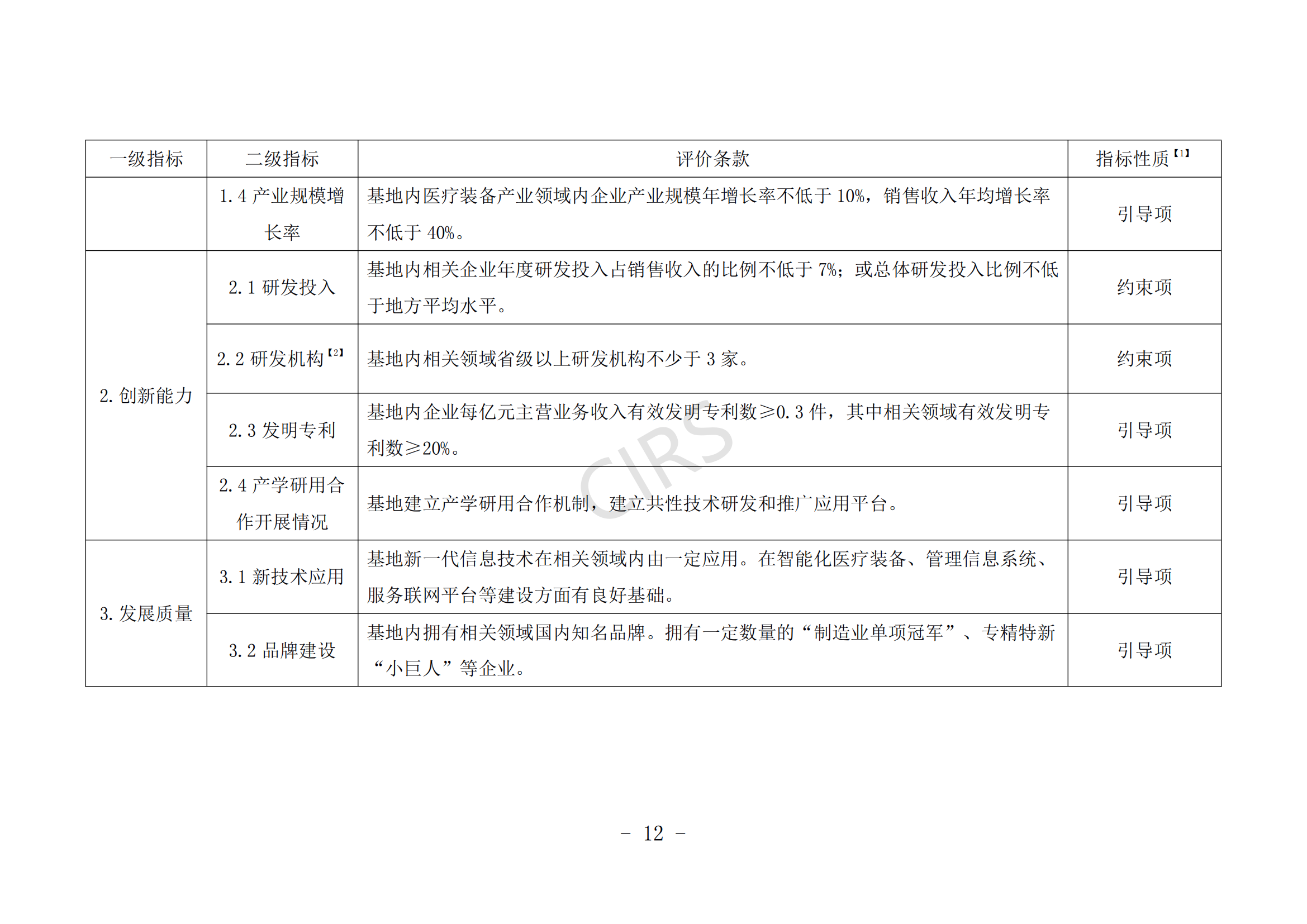
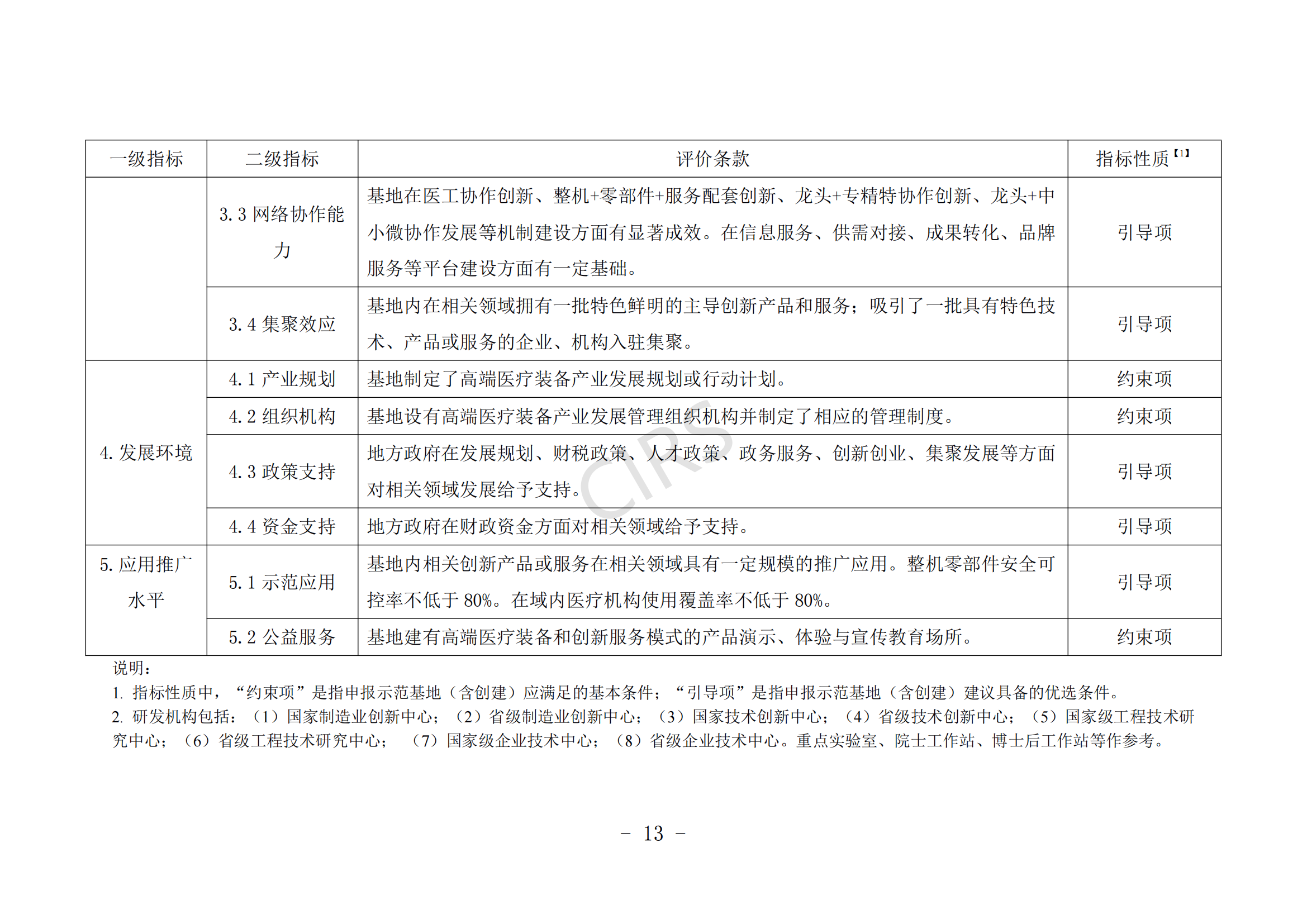
(一)申報主體應在產業鏈培育、產業集聚效應、產業生態體系建設等方面具有一定優勢。
(二)申報主體具有新一代信息技術與醫療裝備產業融合發展能力,具備智能化醫療裝備、管理信息系統、醫療裝備注冊認證服務、知識產權保護運用等公共服務平臺方面的建設基礎。
(三)申報主體在發展規劃、財稅政策、人才政策、創新創業、集聚發展、審評審批、醫保服務等方面對醫療裝備發展有明確的保障措施。
(四)近 3 年內未發生過重大產品(服務)質量事故。
(五)支持醫療機構開展創新醫療裝備臨床研究,所在地有 1 家及以上醫療機構成功開展創新醫療裝備的臨床應用示范。
申報條件具體要求見附件 2。
第九條 申報材料。
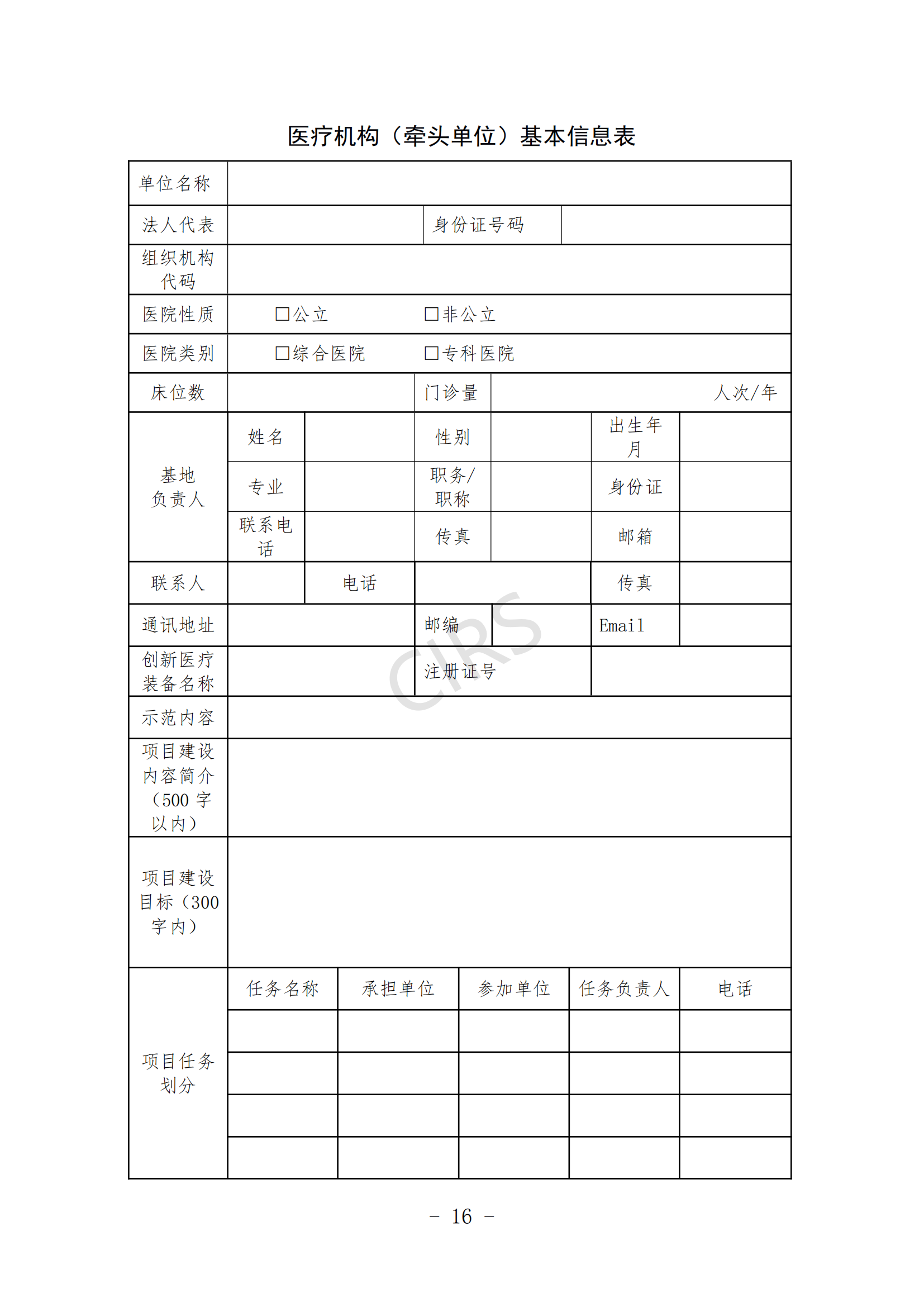
(一)申報書(見附件 3、附件 4)。
(二)省級工業和信息化主管部門、衛生健康主管部門書面推薦意見。
第十條 申報流程。
(一)工業和信息化部、國家衛生健康委定期組織開展臨床應用示范、示范基地建設的遴選和評審工作。臨床應用示范、示范基地建設分年度組織。
(二)申報主體結合自身情況自愿申請,按要求準備申報書及相關材料,提交至牽頭單位所在地省級工業和信息化主管部門、衛生健康主管部門。
(三)牽頭單位所在地省級工業和信息化主管部門會同同級衛生健康主管部門對申報材料開展審查,聯合出具書面推薦意見,并將相關申報材料各一式兩份分別報送至工業和信息化部(裝備工業一司)、國家衛生健康委(規劃司)。
第十一條 評審。
(一)臨床應用示范評審。
工業和信息化部會同國家衛生健康委組織專家對申報材料進行評審。評審結果在工業和信息化部、國家衛生健康委門戶網站公示 10 個工作日。
(二)示范基地建設評審。
工業和信息化部會同國家衛生健康委組織專家對申報單位進行現場考察和答辯評審。評審結果在工業和信息化部、國家衛生健康委門戶網站公示 10 個工作日。
第十二條 命名。
(一)臨床應用示范。
通過評審且公示期無異議的臨床應用示范,由工業和信息化部、國家衛生健康委聯合命名為高端醫療裝備應用示范基地(臨床應用示范:具體示范產品類別),命名有效期限為 3 年。
(二)示范基地建設。
通過評審且經公示無異議的示范基地建設,由工業和信息化部、國家衛生健康委聯合命名為高端醫療裝備應用示范基地(主導產品類別)。
第三章 管理
第十三條 工業和信息化部、國家衛生健康委指導推薦單位加強對臨床應用示范的日常指導和監督管理,不定期組織專家對臨床應用示范推進情況開展檢查評估,對于評估不通過的,取消命名。
第十四條 工業和信息化部、國家衛生健康委對示范基地實施動態管理。每年 3 月底前,示范基地應將上一年度工作總結和本年度工作計劃報至推薦單位。推薦單位核實匯總后,分別報工業和信息化部(裝備工業一司)、國家衛生健康委(規劃司)。對于連續兩年未按規定報送年度工作總結和計劃的,撤銷命名。撤銷命名前將告知有關單位,聽取其陳述和申辯。
第十五條 對申報單位存在提供虛假材料騙取評審、稱號命名等嚴重違法違規行為的,一經發現將取消命名資格。3 年內不得重新申報示范基地。
第十六條 對于出現重大安全、質量事故或違法違規違紀等行為的臨床應用示范或示范基地建設,將撤銷其命名,并移交相關部門按程序處理。撤銷命名前將告知有關單位,聽取其陳述和申辯。
第十七條 工業和信息化部、國家衛生健康委對示范成果推廣應用和示范基地建設予以支持。根據實際情況在產學研檢用金合作、技術推廣、標準制定、項目推薦、交流合作等方面對于重點指導和支持。對具有顯著臨床應用價值的創新醫療裝備,優先推薦至優秀醫療設備目錄等;對符合條件的首臺(套)高端醫療裝備,優先推薦至《首臺(套)重大技術裝備推廣應用指導目錄》。
第四章
附 則
第十八條 本辦法由工業和信息化部、國家衛生健康委負責解釋。
第十九條 本辦法自 2022 年 月 日起施行。