對 新型冠狀病毒 的檢查分為實驗室檢查和病原學檢查。 實驗室檢查包括一般檢查,病原學及血清學檢查,胸部影像學檢查等。病原學檢查又包括核酸檢測和抗原檢測。
新冠抗原檢測試劑是 以抗原抗體反應為原理,對鼻拭子、咽拭子、鼻咽拭子等上呼吸道樣本中的新型冠狀病毒(2019-nCoV )抗原進行體外定性的檢測試劑。
1、新冠抗原檢測試劑臨床試驗指導原則及標準
|
序號 |
指導原則 / 標準名稱 |
發布時間 |
|
1 |
《體外診斷試劑注冊與備案管理辦法》(國家市場監督管理總局令第48號) |
2021-08-31 |
|
2 |
《體外診斷試劑分類規則》 |
|
|
3 |
《 新型冠狀病毒(2019-nCoV)抗 原 檢測試劑注冊審查指導原則 》 |
2022-04-27 |
|
4 |
《 體外診斷試劑臨床試驗技術指導原則 》 |
2021-09-16 |
2、臨床試驗要求
|
目錄 |
具體要求 |
|
機構與倫理 要求 |
(1) 新冠病毒抗體檢測試劑臨床試驗應按要求在 3 家以上 ( 含 3 家 ) 臨床試驗機構進行 ; (2) 開展臨床試驗的機構應按要求經國家藥品監督管理局醫療器械臨床試驗機構備案系統備案 。 |
|
(3) 有倫理委員會或區域倫理的,提供倫理批件(時間在報告之前即可); (4) 無倫理委員會的,機構出具無倫理委員會的聲明,并聲明允許在本機構開展臨床試驗 。 |
|
|
(5) 注意事項 :定點醫院;目標人群,樣本量充足;確診與排除病例全部涵蓋;病例背景信息齊全且能夠提供;能夠配合臨床試驗倫理及簽章。 |
|
|
(6) 試驗方法 : 采用試驗體外診斷試劑與已上市、靈敏度較高的新型冠狀病毒核酸檢測試劑進行對比試驗的方法,對產品臨床性能進行評價 。 試驗體外診斷試劑檢測可由經專業培訓的實驗室人員操作,或者由非專業使用者進行檢測。 |
|
|
(7) 注意事項 : ①如試驗體外診斷試劑檢測由非專業使用者進行檢測 ,為了實現盲法操作,避免因受試者已經知曉自身的感染狀態而引入偏倚,臨床試驗應按照方案要求順序納入新型冠狀病毒肺炎的疑似病例,不應納入已知感染狀態的受試者。 ② 如試驗體外診斷試劑由經專業培訓的實驗室人員檢測 ,應同時選取一定量受試者進行新型冠狀病毒抗原檢測試劑非專業使用者檢測與經專業培訓的實驗室人員檢測的對比試驗。 |
|
|
入組人群 要求 |
(8) 新型冠狀病毒抗原檢測主要適用于急性感染期患者,建議為出現癥狀后 7 天之內的患者。 (9) 陽性病例應包括不同病毒載量(根據同步核酸檢測結果確定)的病例,以及出現癥狀不同時間( 1 ~ 7 天)的病例;陰性病例應包括有疑似癥狀的其他呼吸道病原體感染病例等。 |
|
樣本量 要求 |
(10) 分兩種 : ① 針對新型冠狀病毒抗原檢測試劑與新型冠狀病毒核酸檢測試劑的對比試驗 , 建議對比試劑(核酸檢測試劑)檢測陽性樣本不少于200例,陰性樣本不少于 300 例 。以核酸檢測試劑陽性判斷值 Ct ≤ 38 為例,建議 Ct 值≤ 30 的陽性樣本例數不低于 170 例, Ct 值> 30 的陽性樣本例數不低于 30 例。 ② 針對新型冠狀病毒抗原檢測試劑非專業使用者檢測與經專業培訓的實驗室人員檢測的對比試驗,建議納入至少70例抗原陽性受試者, 70 例抗原陰性受試者,應盡可能納入尚未確認新型冠狀病毒感染狀態的疑似病例 。 |
|
臨床試驗結果的統計分析 |
(11)臨床試驗結果一般以2×2表的形式進行總結,并據此計算陽性符合率、陰性符合率、總符合率及其 95% 置信區間。同時應針對不同病毒載量(根據核酸檢測結果)和不同樣本類型等進行分層分析。 |
|
(12)按eRPS提交要求準備資料 ① 簽字蓋章符合法規要求; ② 數據表內容符合要點要求; ③ 注意明確發病日期、樣本采集日期、發病到樣本采集天數、病程階段、核酸檢測結果、確診/排除結論、疾病背景信息。 ④ 疾病背景信息:應與新冠疾病相關,能夠判斷為疑似病例。 |
|
|
臨床試驗數據匯總表 |
(13) 臨床試驗數據匯總表作 為臨床試驗報告的附件提交。 ① 數據表中應包括檢測病例的編號、年齡、性別、樣本類型、采集時間、臨床診斷背景信息、本產品檢測結果及新型冠狀病毒感染的確診或排除結果等,同時請明確疾病確診所采用的核酸檢測結果(包括核酸檢測試劑名稱)。 ② 臨床應用的數據集中每一病例編號應能夠溯源。鑒于抗原、抗體的產生與病原體感染病程密切相關,建議在臨床背景信息中詳述患者發病時間、癥狀變化、疾病轉歸等(具體要求參見 下 表) |
3、 臨床實驗數據匯總表
|
受試者編號 |
年齡 |
性別 |
樣本類型 |
確診/排除結果 |
臨床診斷背景信息 |
考核試劑檢測結果 |
核酸檢測結果 |
采樣時間 |
|
備注: a)原則上每個病例均應明確確診/排除結果,如有核酸檢測為陰性且具有肺炎影像學特征,無法排除的病例應在確診/排除結果一欄特別注明。 b)確診病例應明確采樣時間點的病程階段:初期、中期或治療后期/恢復期等。 c)受試者編號應唯一可溯源。 |
||||||||
附 :
新冠抗原檢測試劑結果判讀
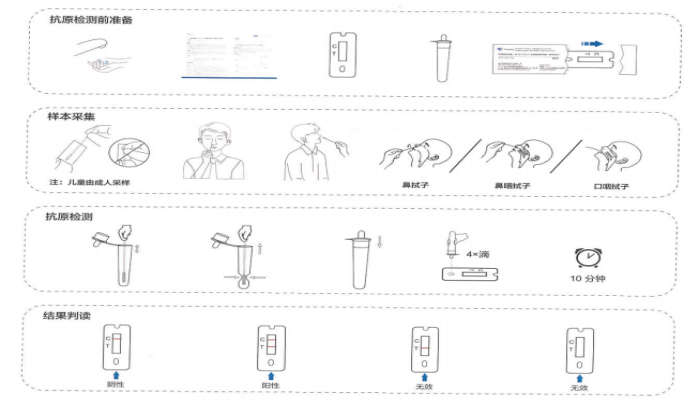
新冠抗原注冊臨床試驗,請聯系:張經理
杭州:135 8840 4338(同微信)
北京:150 1020 1703(同微信
