在保健食品注冊新規實施的背景下,為規范原衛生部等過去不同時期批準的“無有效期、無產品技術要求”(以下簡稱“雙無”)保健食品注冊證書,市場監管總局于2023年12月27日發布《在產在售“雙無”保健食品集中換證審查要點(征求意見稿)》,并公開征求意見,截止時間為2024年1月26日。
根據瑞旭集團此前的統計,已獲批準的“雙無”產品數量接近萬數,換證規模龐大。本文旨在對集中換證的大體流程、要點等進行梳理和解讀,助力企業順利完成新規下的產品換證工作。
換證范圍
過渡期內(自2023年8月31日起5年內),持有效生產許可的“雙無”產品。
換證程序及要求
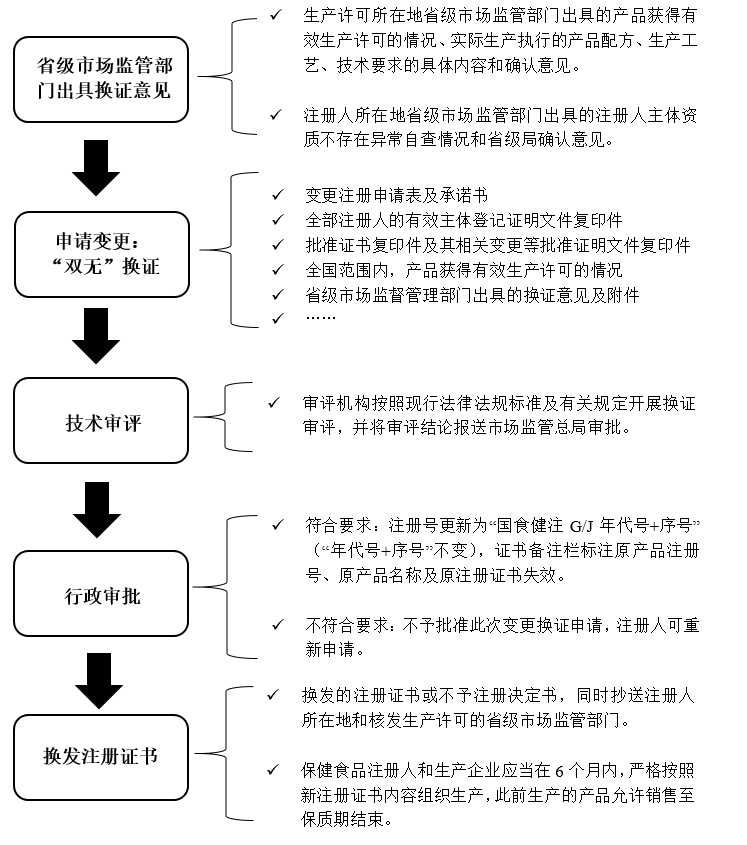
要點關注
(1)關于品名:產品名稱應當符合現行規定。保留產品名稱理由合理的,允許保留原產品名稱。
(2)除了八類功能需要重(補)做功能學試驗,征求意見稿中涉及檢測的其他情形:
情形 | 要求 |
原料無使用依據或原料用量超出現行規定 | 按現行規定調整配方(含替換原料),按新產品注冊重新開展毒理、功能、衛生學、穩定性等驗證試驗 |
配方含有保健食品新原料,原注冊時未提供原料安全性評價材料 | 按照《保健食品及其原料安全性毒理學檢驗與評價技術指導原則(2020年版)》有關要求進行新原料及產品的安全性評價和關聯審查 |
配方含有2個及以上保健食品新原料,原注冊時未提供原料安全性評價材料 | 按照《保健食品及其原料安全性毒理學檢驗與評價技術指導原則(2020年版)》對每個新原料及產品進行急性經口毒性試驗、三項遺傳毒性試驗、90天經口毒性試驗和致畸試驗,以及新原料與產品的關聯審查 |
產品技術要求涉及增訂、修訂質控指標 | 提交修訂說明以及相應的衛生學、穩定性、功效成分/標志性成分檢驗報告等資料 |
產品技術要求涉及增訂功效成分/標志性成分指標,以及理化指標檢測方法為注冊人自行研究制定 | 提供檢測方法學驗證等相關研究資料 |
對原料質量標準等內容進行調整,涉及產品物質基礎實質性改變 | 按照新產品要求重新開展毒理、功能、衛生學、穩定性、功效成分/標志性成分等驗證試驗 |
(3)關于進口保健食品:免于提供“生產許可所在地省級市場監督管理部門出具的換證意見”,按要求提供資質證明文件等其他材料。
瑞旭觀點
據相關部門統計,獲得生產許可的“雙無”保健食品約1800款,過渡期內,市場監管總局的換證工作將以這些產品為重點開展。建議有換證需求且產品在產在售的企業按照征求意見稿中的要求,提前準備相關材料,爭取在過渡期內完成換證工作。未持有效生產許可的“雙無”產品,獲得生產許可后,可按程序提出換證申請。
官方公告:
市場監管總局關于公開征求《在產在售“雙無”保健食品集中換證審查要點(征求意見稿)》意見的公告
作者:章淑寅
