2023年11月8日、11月9日,國家市場監督管理總局食品審評中心分別就保健食品的2個常見問題和2個共性問題進行了解答,詳情見下。
常見問題:
1.《允許保健食品聲稱的保健功能目錄 非營養素補充劑(2023年版)》發布后,申報材料的申請表中的保健功能應如何填寫?
答:新產品申請表中保健功能一項應按新的功能目錄填寫;變更、延續、轉讓、補發申請表中保健功能應與獲批證書中載明內容保持一致。
2. 保健食品紙質版受理通知書依然需要領取嗎?
答:目前保健食品注冊管理信息系統系統升級,申報端可以領取電子版的受理通知書。故現場遞交申報材料的可不再領取紙質版受理通知書;郵寄申報材料的,受理大廳也不再郵寄紙質版受理通知書。
如有特殊情況,需要領取或郵寄的,請在申報材料隨附說明。
共性問題:
1. 對于保健食品功能論證報告中功能聲稱科學依據的要求?
答:科學依據及其相關綜述內容應當完整規范,不僅包括科學依據的來源、目錄和全文,還應當與產品的配方、工藝等技術要求進行研究比對,對產品配方及其功能聲稱科學依據充足性進行論證和綜述。文獻依據包括在國內核心專業期刊或國際專業期刊正式發表的科研論文;我國傳統本草典籍的有關記述;文獻分析和評價報告;國際公認的食品衛生權威機構、組織,或我國有關部門、權威機構正式發布的國際標準、國家標準、風險評估報告、統計信息等,匯總信息應完整準確,能夠對產品配方及其功能聲稱形成有效支撐。報紙、網評、非科研雜志、專利文書、產品宣傳頁等不屬于國內核心專業期刊等資料,視為無效資料,不納入審評范圍。
鼓勵申請人對產品配方主要原料的功能依據及其他原料的配伍必要性相關文獻依據,進行全面系統的檢索和篩選,通過Meta分析等方法進行文獻系統分析,提出對產品保健功能科學依據充足性和配方合理性的文獻分析和評價報告。
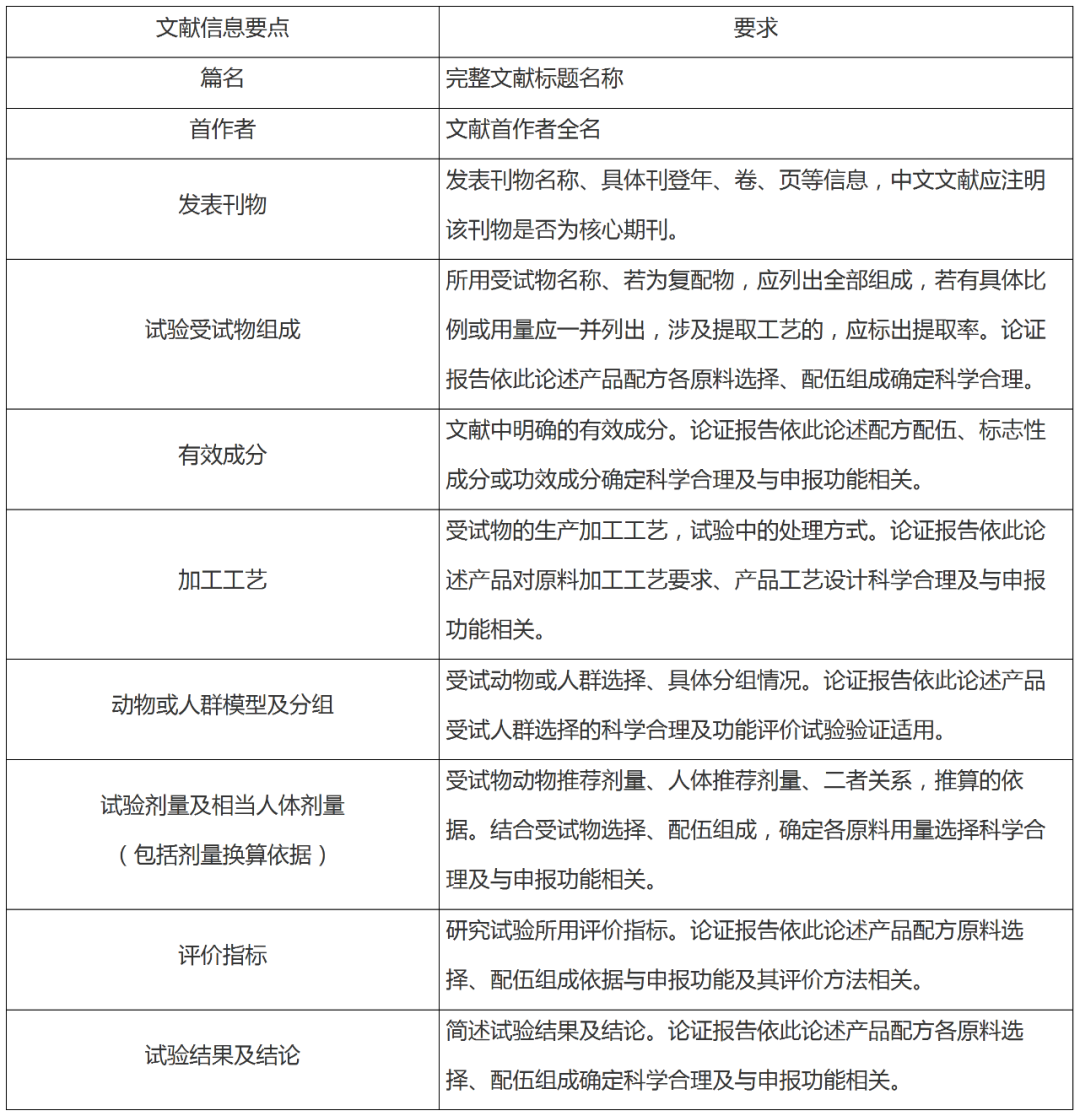
2. 對于保健食品功能論證報告中引用文獻匯總表的要求?
答:應包括篇名、首作者、發表刊物及是否為核心期刊、試驗受試物組成、主要成分、加工工藝,動物或人群模型及分組、試驗劑量及相當人體劑量(包括劑量換算依據)、評價指標,試驗結果及結論等信息。要求見下表: