9月18日,FDA對化妝品的工廠注冊和產品清單登記系統擬收集的信息開啟意見征求,包括公開電子提交門戶(Cosmetics Direct)頁面,以及兩類紙質提交表格(FDA表格5066和5067)的草稿發布。意見征集截至2023年10月18日。
一. 電子提交門戶
名稱被定為Cosmetics Direct,與藥品注冊平臺CDER Direct同屬于FDA Direct。頁面展示如下:
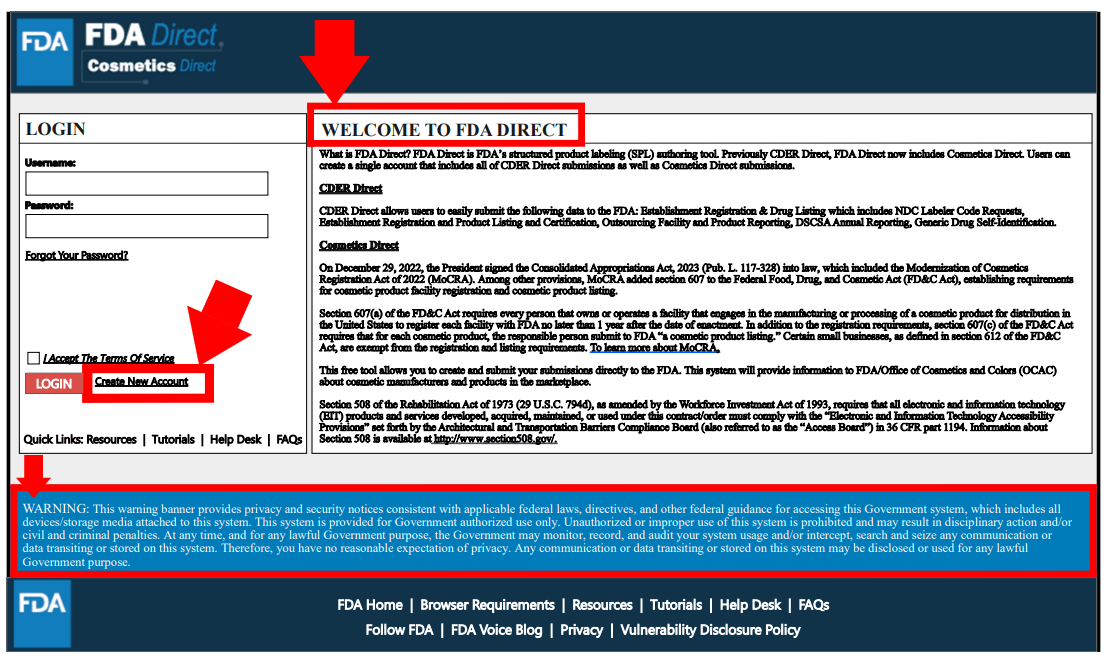
創建賬戶
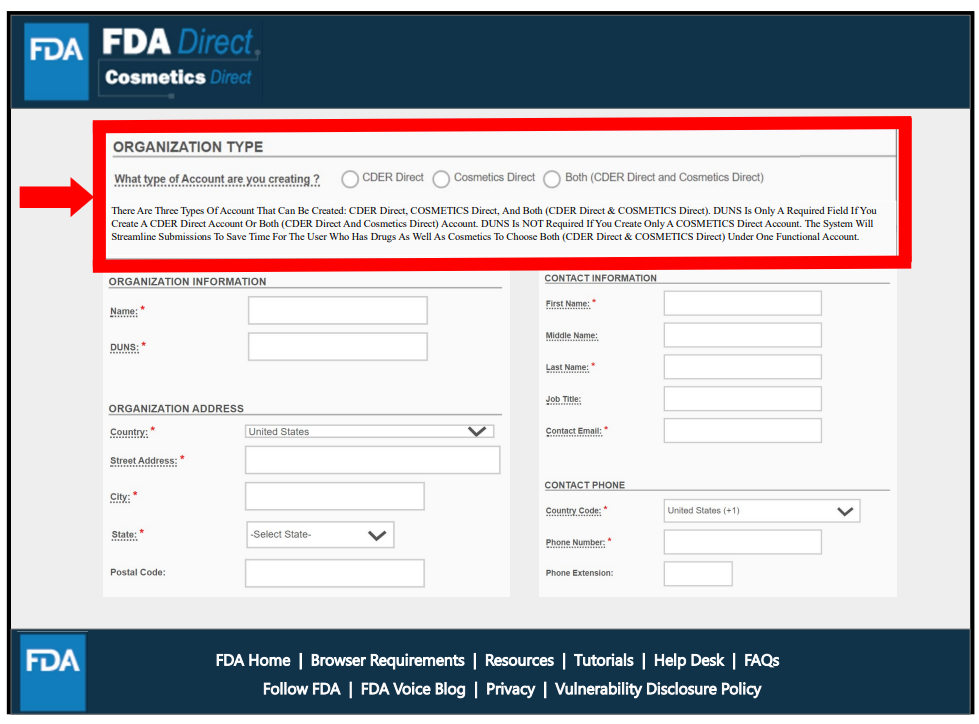
3種形式,可以創建獨立的CDER Direct或COSMETICS Direct賬號,也可同時開通兩者。但僅創建Cosmetics Direct賬戶的無需提供鄧白氏碼(DUNS Number)。該過程需提交機構名稱、地址、聯系信息等。圖中標星號為必填項。
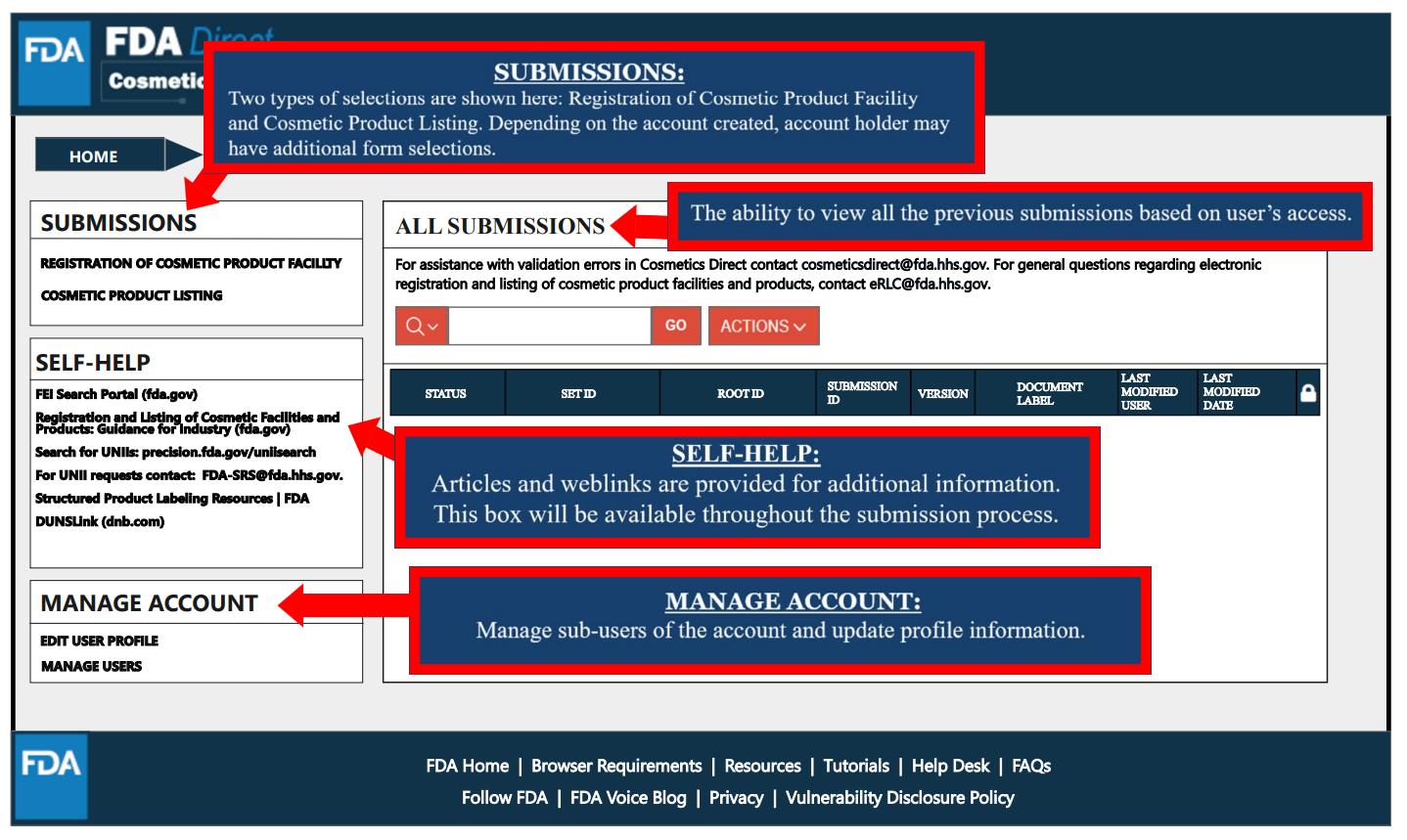
Cosmetics Direct主頁面包括注冊登記入口(可進行設施注冊以及產品清單登記)、注冊登記記錄以及相關的FDA鏈接。
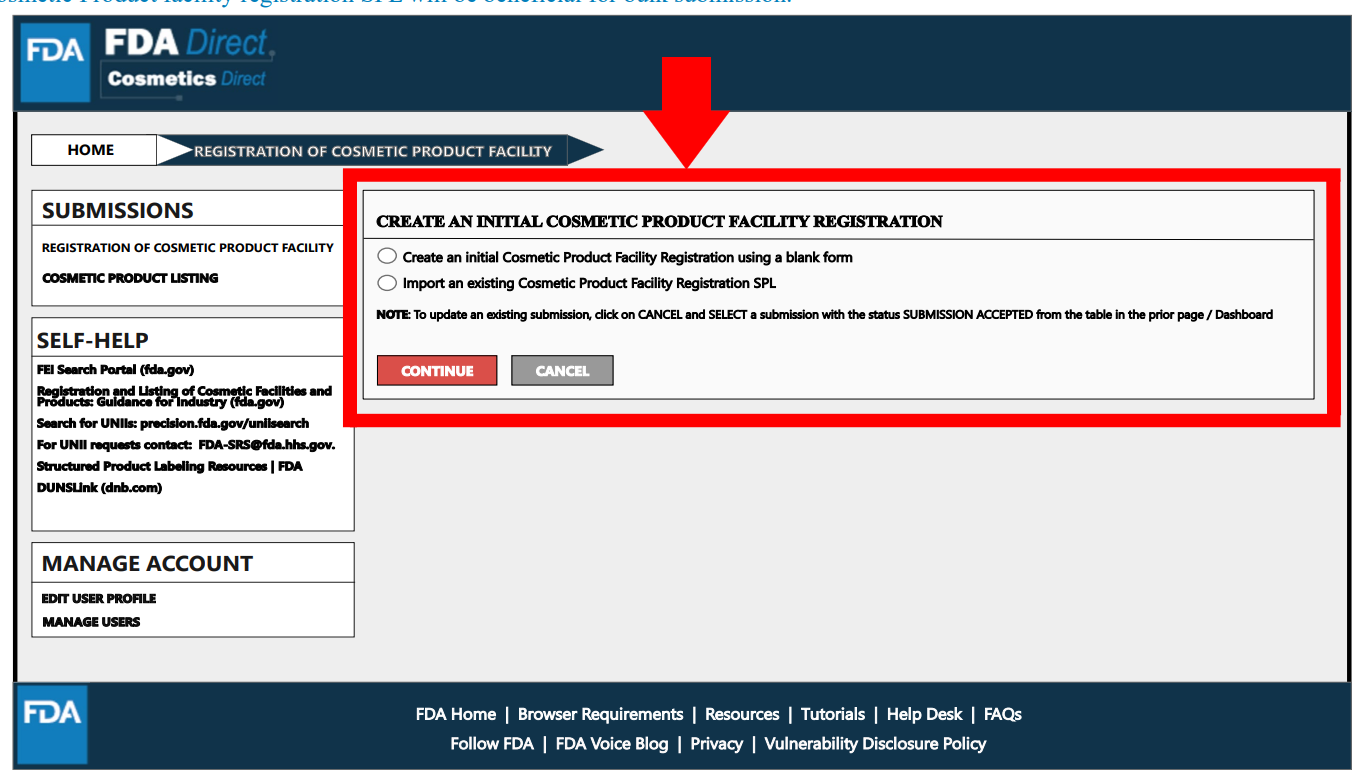
設施注冊/工廠注冊
在“SUBMISSIONS”處選擇設施注冊,出現以下頁面,可選擇在平臺上創建電子表格或上傳SPL文件。
選擇在平臺上創建電子表格后出現信息提交頁面。其中,在Document Type Details處,Document Type是指企業注冊類型;Set ID和Root ID是系統自動生成的,Set ID是標識唯一的SPL文件,當提交的SPL發生變化時,新的Root ID會分配給新的SPL;生效日期是提交創建的日期。
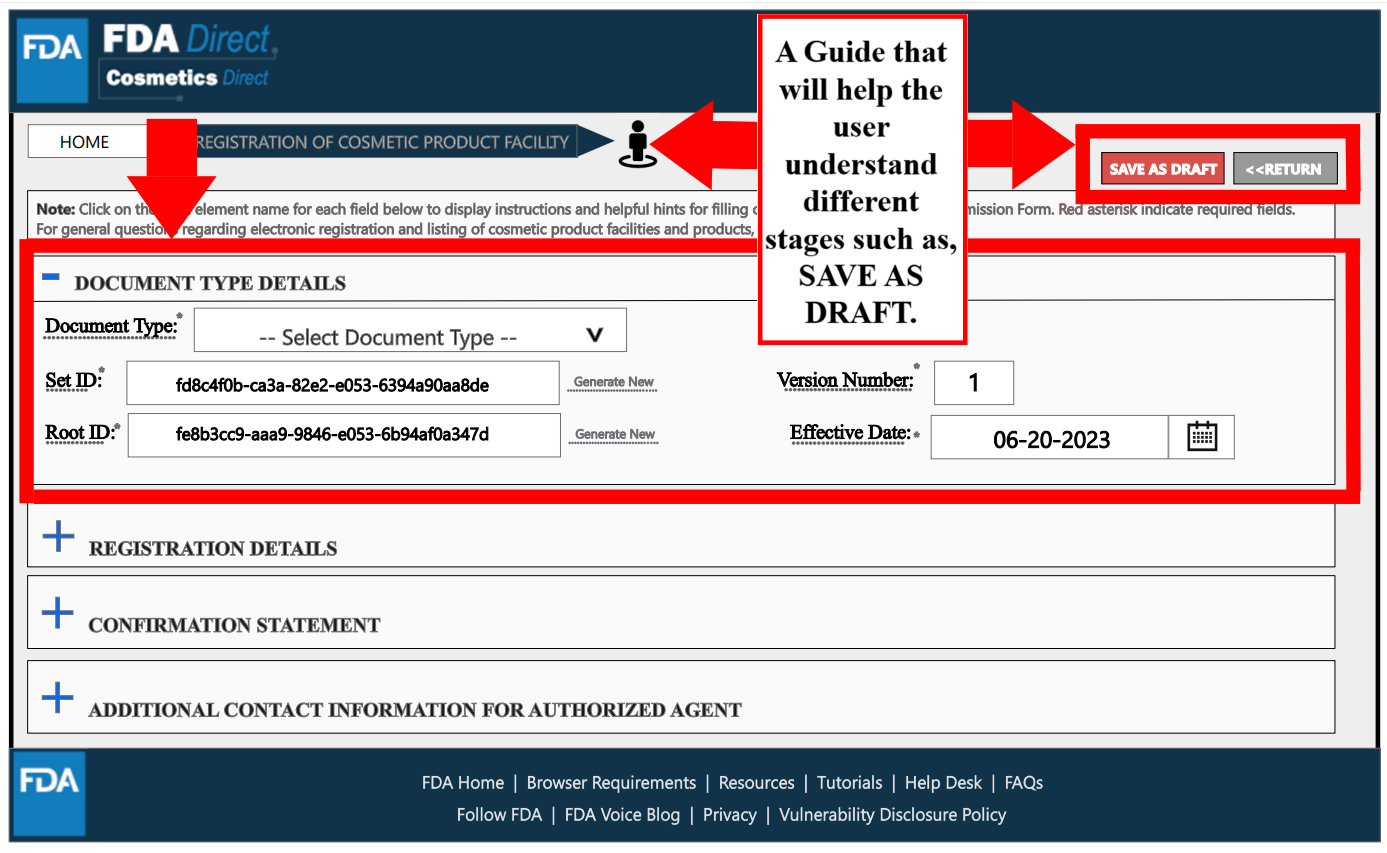
在Registration Details處,紅色框中標星號的是必填項,包括工廠名稱、FEI號(屬于豁免注冊的工廠且沒有FEI號,可以提供企業名稱和地址)、工廠聯系信息。
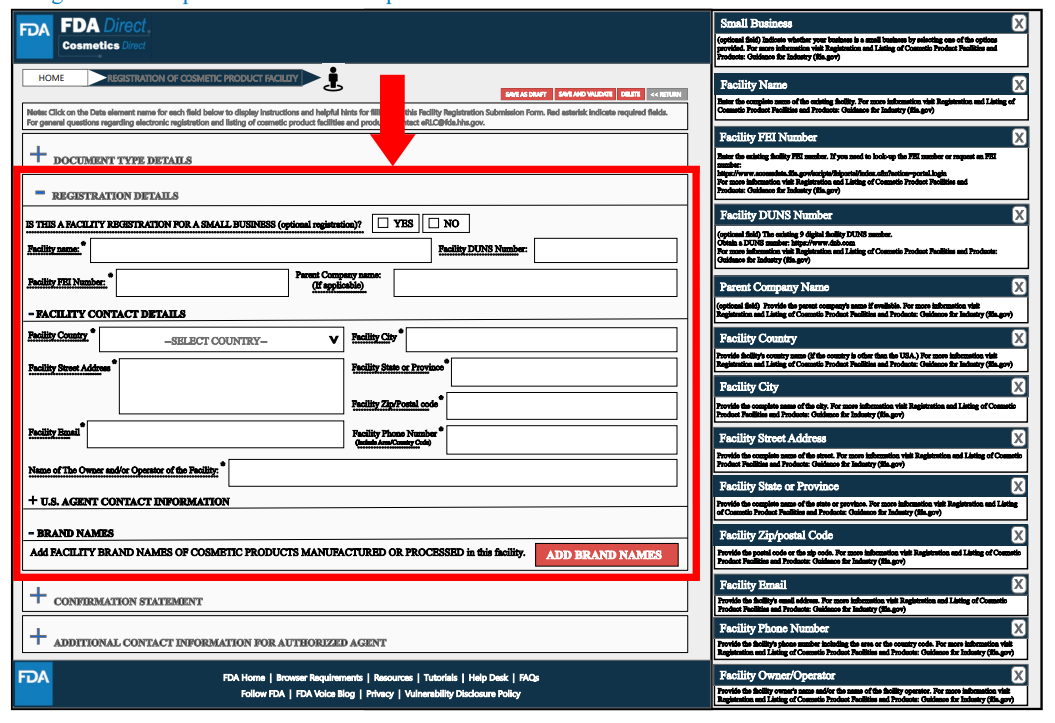
此外,還需要填寫美國代理人的信息和聯系方式。
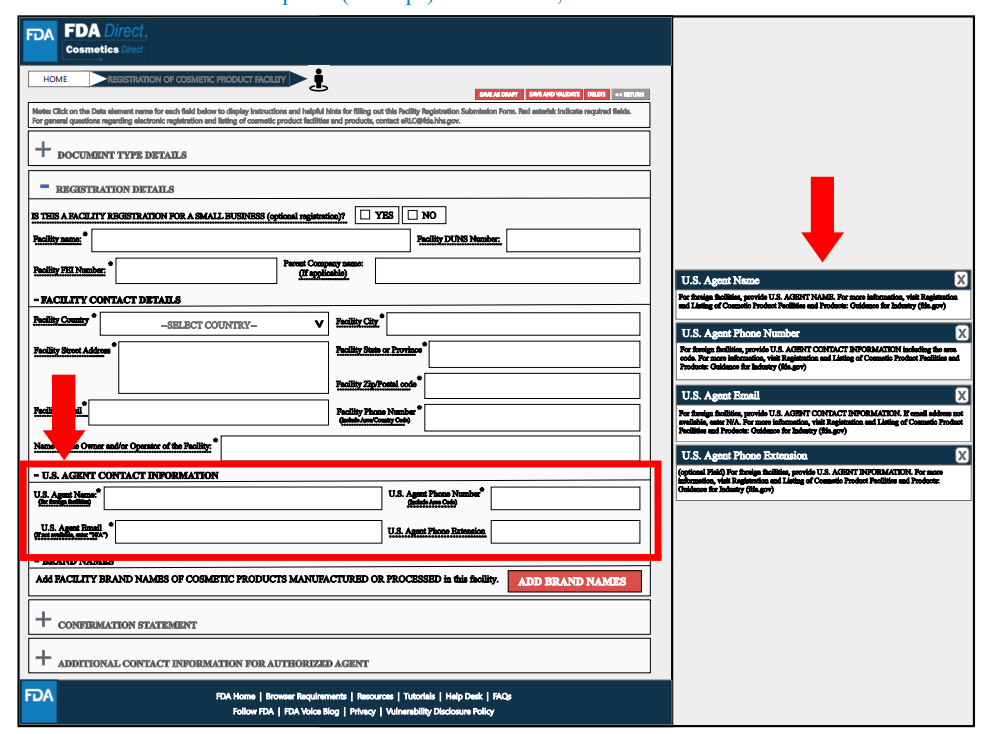
在Brand Name(s)處,通過選擇“添加品牌名稱”提交在該工廠生產或加工的化妝品品牌名稱,并選擇適用于此品牌名稱的所有類別代碼。可以提交多個品牌信息。
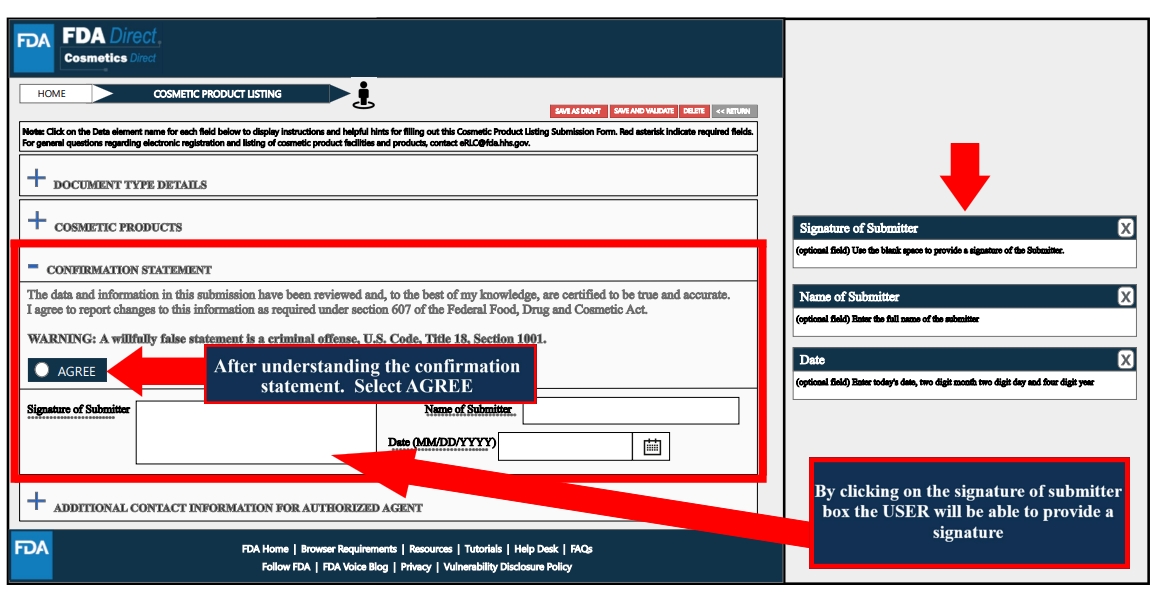
Confirmation Statement處,了解確認聲明后,選擇“同意”;隨后進行簽字確認。
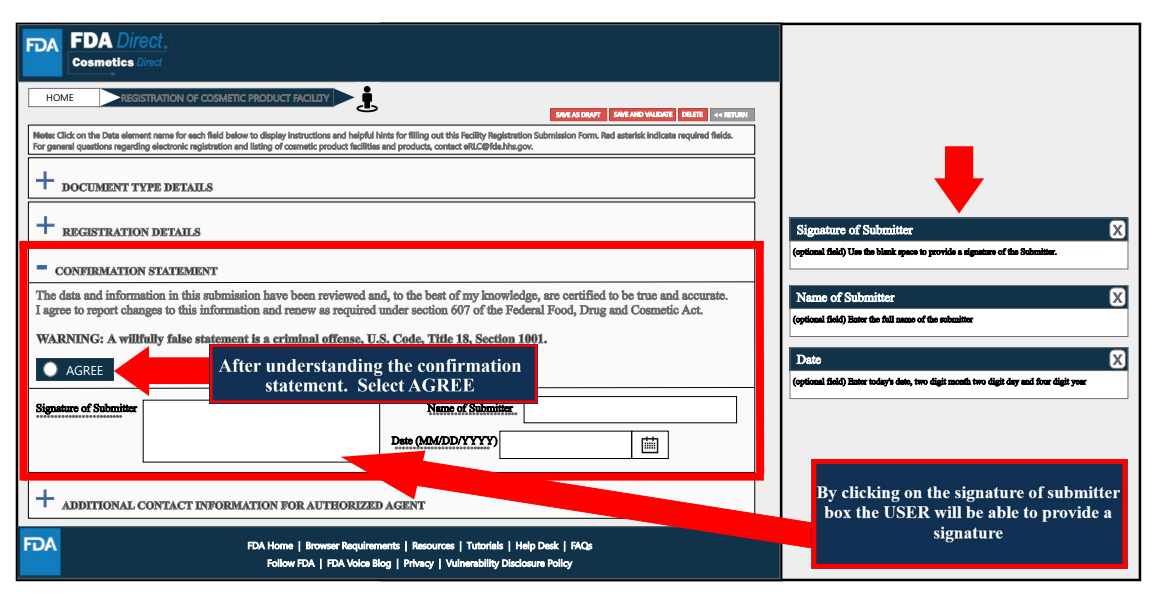
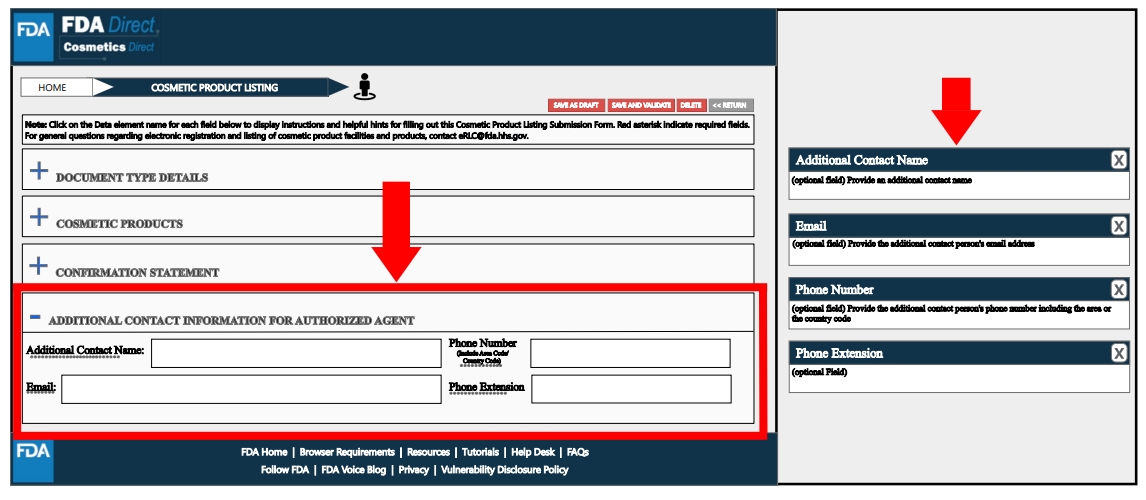
Additional Contact Information for Authorized Agent處,根據工廠實際情況填寫相關信息,如附加的聯系人名稱、電話、電子郵箱等。
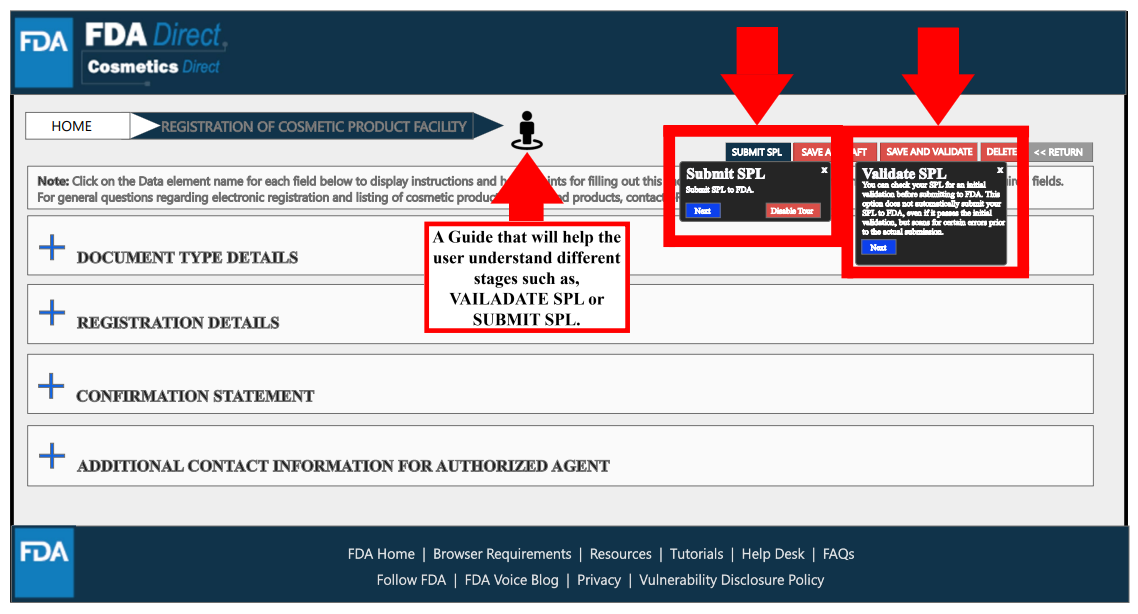
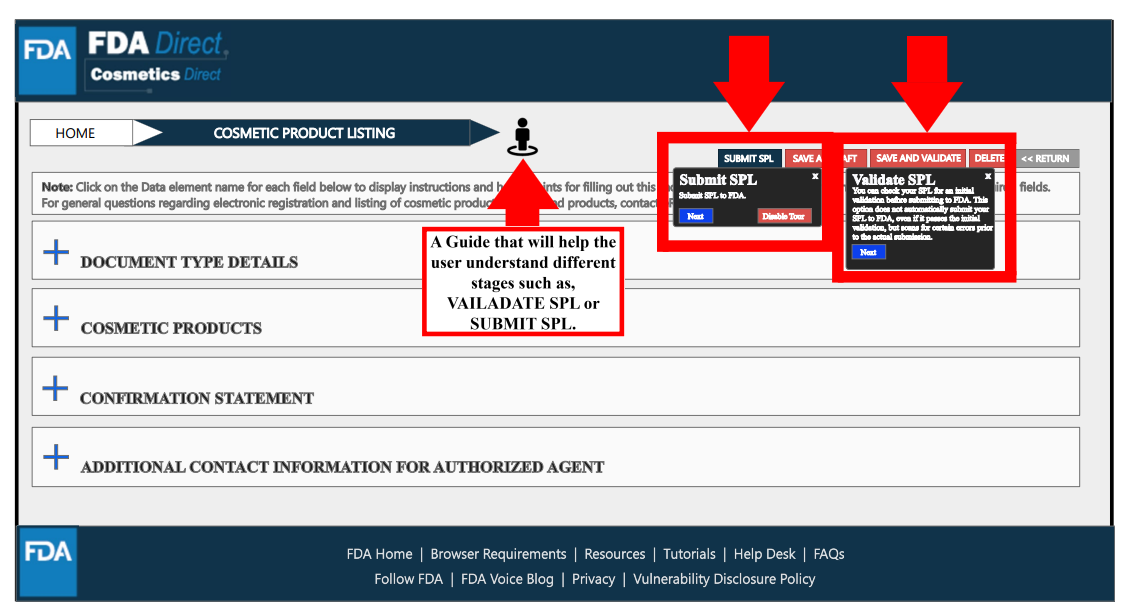
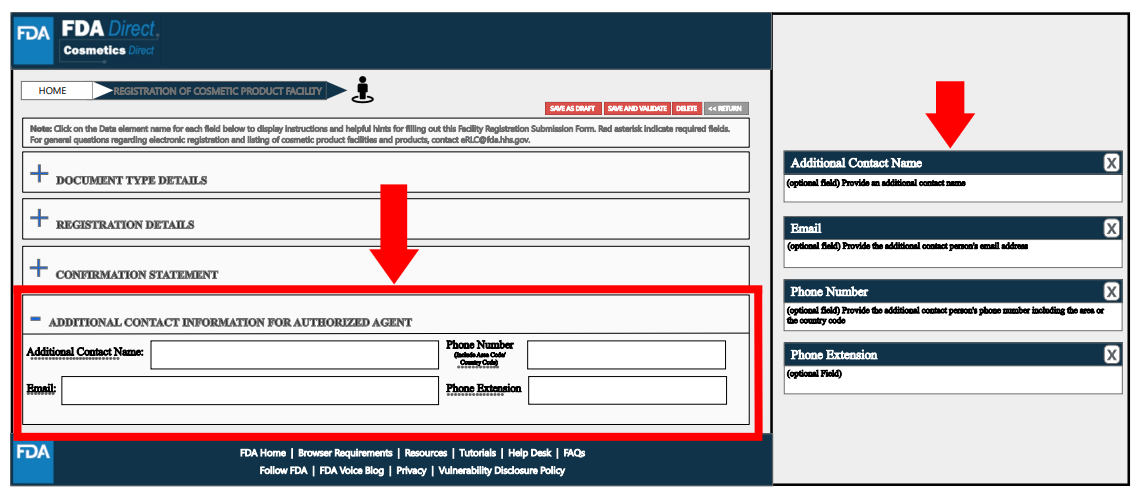 在填寫所有必要信息后,選擇“保存和驗證”以識別任何錯誤,或是選擇“提交SPL”以將表單提交給FDA。
在填寫所有必要信息后,選擇“保存和驗證”以識別任何錯誤,或是選擇“提交SPL”以將表單提交給FDA。
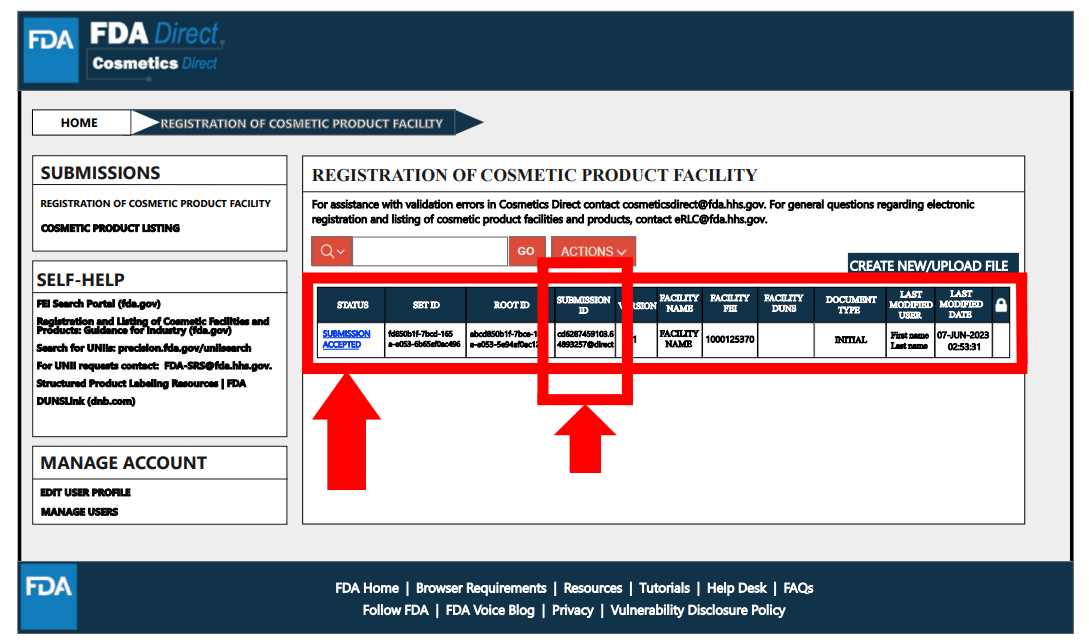
完成注冊流程后,狀態將變為“提交已接受”,并會獲得工廠注冊號碼。
產品清單登記:
與工廠注冊一樣,只需在“SUBMISSIONS”處選擇產品清單登記即可,隨后也會出現選擇在平臺上創建電子表格或上傳SPL文件頁面。
Document Type Details處,Document Type是指產品清單登記類型;Set ID、Root ID以及生效日期與設施注冊中的解釋一致。
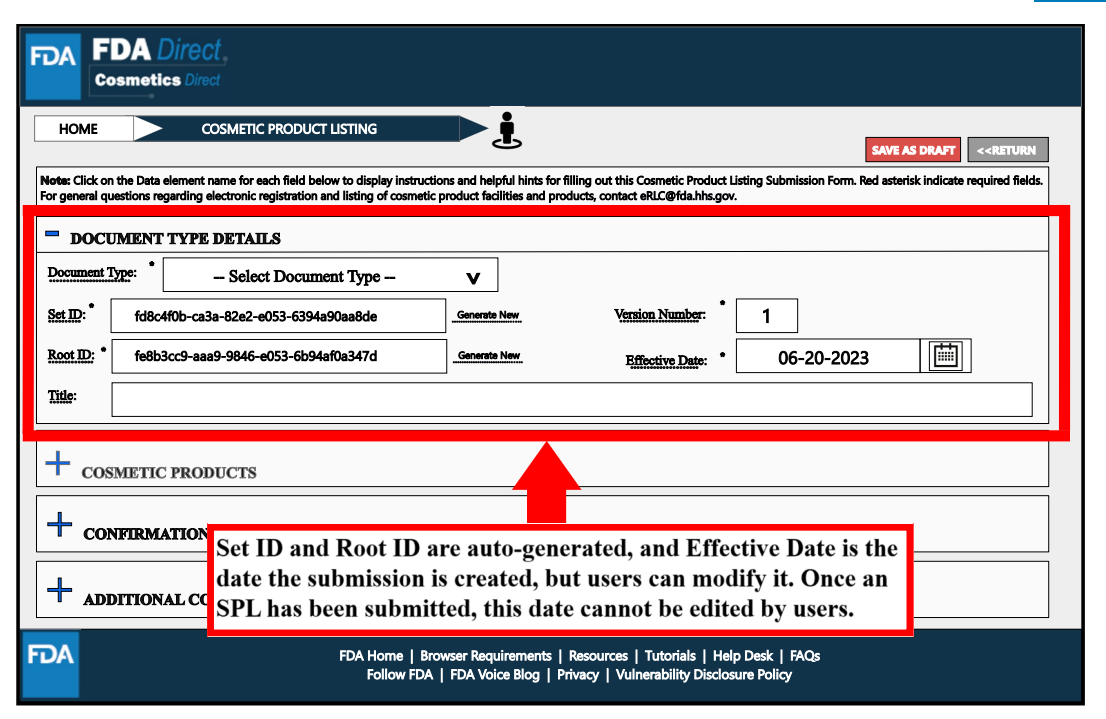
Cosmetic Products處,紅色框中標星號的是必填項,主要包括責任人相關信息。
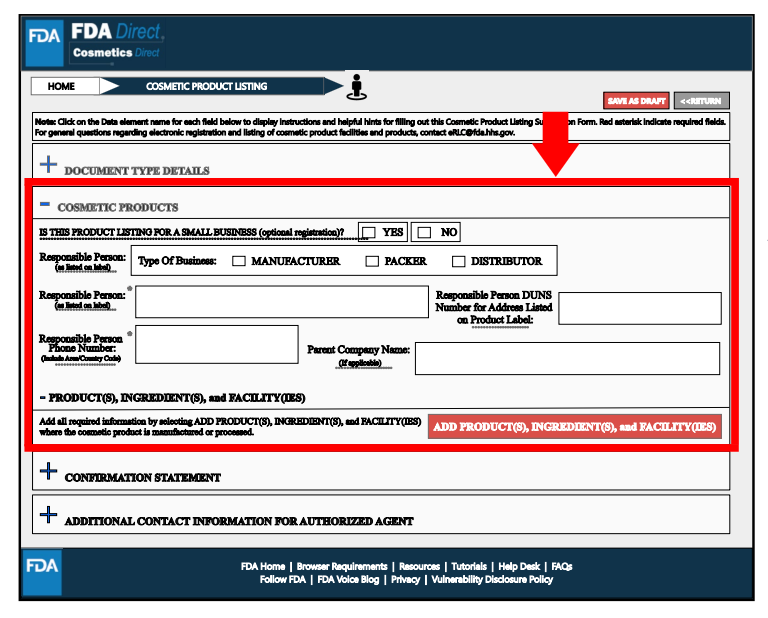
Products, Ingredients, and Facilities處,提供生產或加工的化妝品產品名稱、成分、標簽、生產企業等信息。
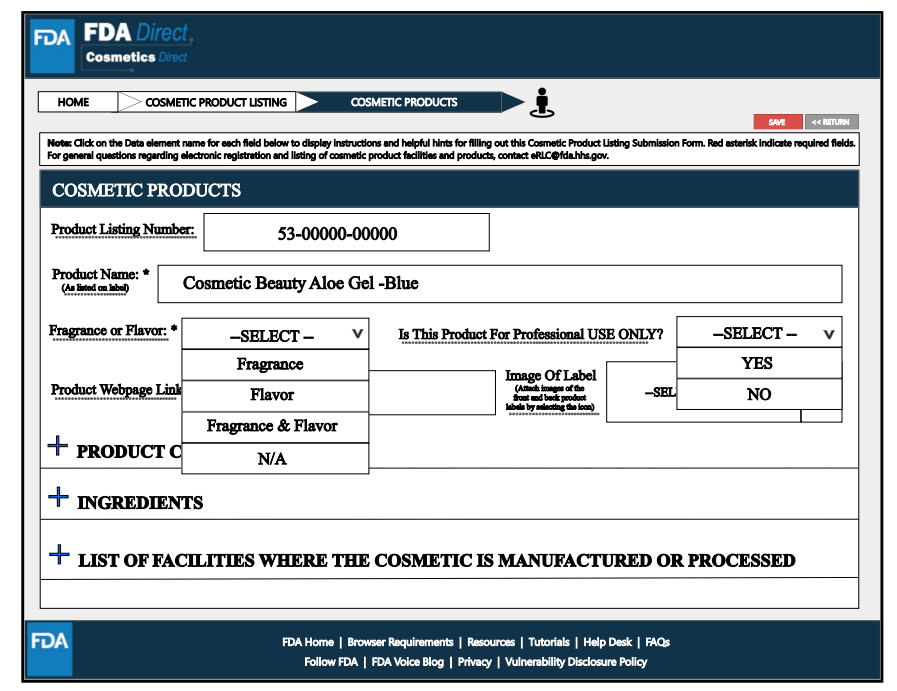
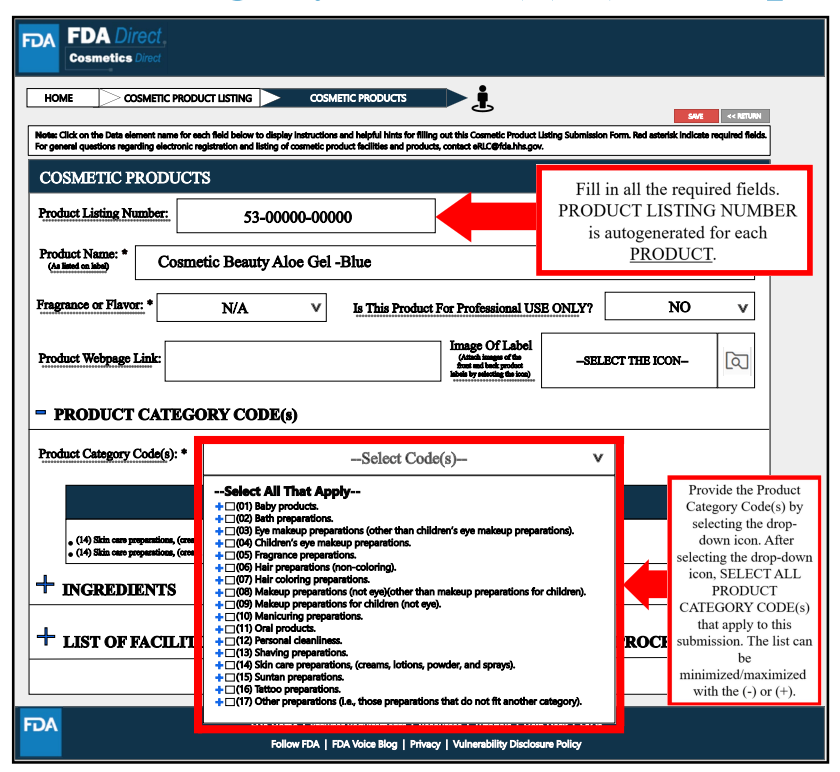
其中,在Product Category Code(s)處,要填寫所有必填信息。選擇適用于提交的所有產品的類別代碼。
INGREDIENTS處,需要填寫清單中產品的所有成分信息,包括原料的名稱(按照美國的原料命名規則,可參考CIRS解讀“美國對化妝品用原料的管理”)以及UNII編號,但不需要填寫配方中原料使用的濃度信息。原料信息可通過文件上傳,但暫未說明文件格式要求。

List of Facility處,需要填寫生產或加工化妝品產品的工廠信息,此處也需要填寫FEI號,其要求與設施注冊中的一致。

以上信息填寫完成后,選擇“保存”并彈出以下頁面。產品、成分以及工廠信息會展示在下方表格中,且表格最后出現的“CLONE”是對系列產品的工作簡化:具有相同配方或僅在顏色或香味上有所不同的多個化妝品產品,通過選擇該按鍵,系統將復制成分清單和設施地址。
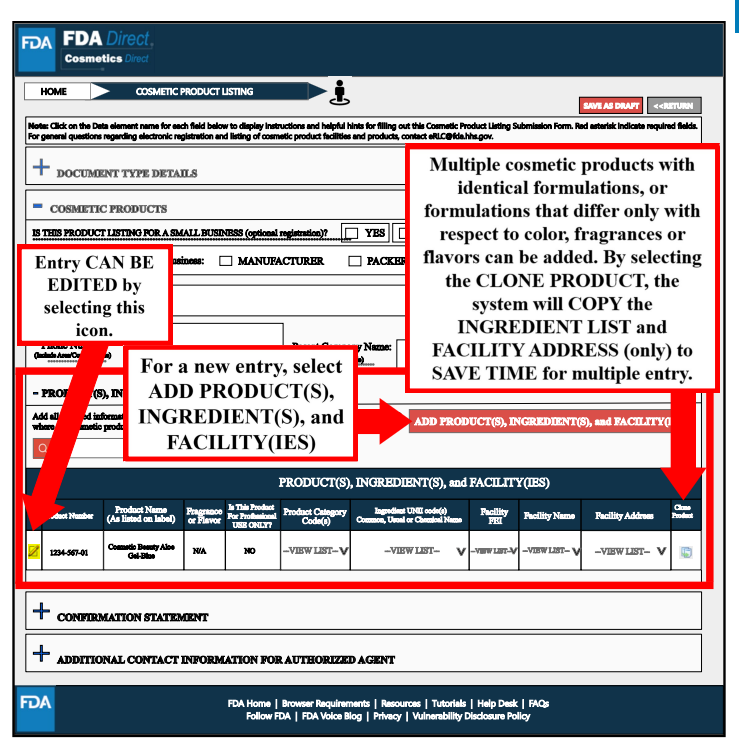
Confirmation Statement處,了解確認聲明后,選擇“同意”;隨后進行簽字確認。
可在dditional Contact Information for Authorized Agent處,填寫附加聯系人姓名的相關信息(如有)。
在填寫所有必要信息后,選擇“保存和驗證”以識別任何錯誤,或是選擇“提交SPL”以將表單提交給FDA。
在完成產品清單登記流程后,狀態將變為“提交已接受”,并分配一個產品清單登記的ID。
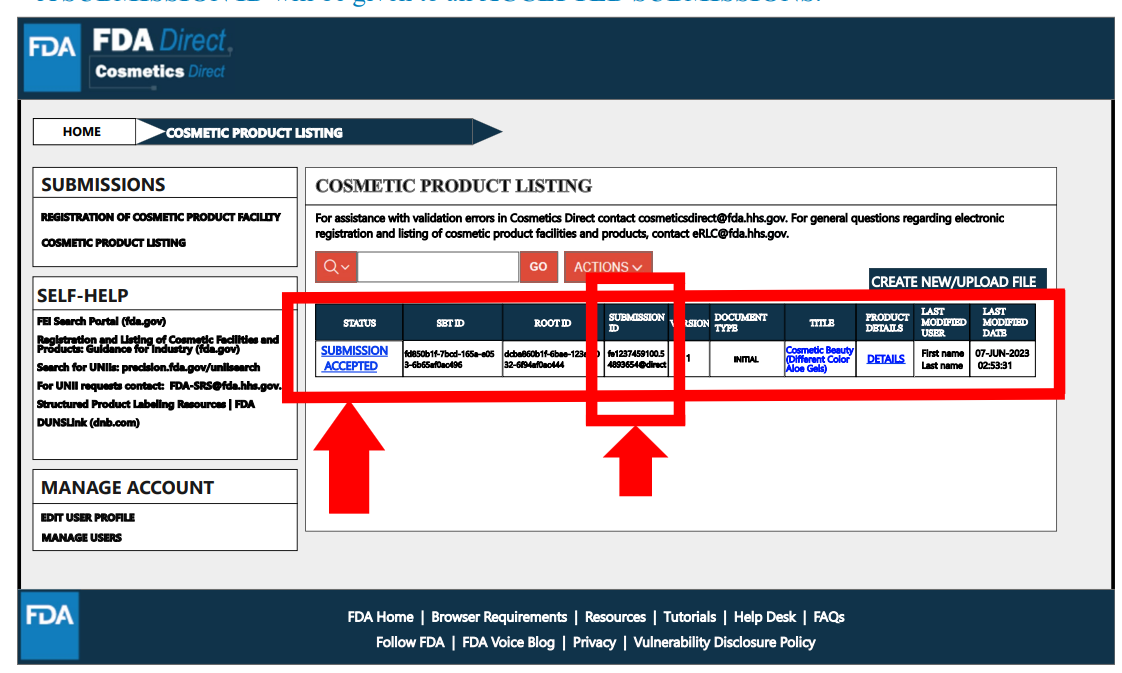
二. 紙質提交形式
- 5066為工廠注冊登記表,以下為表格的部分信息:

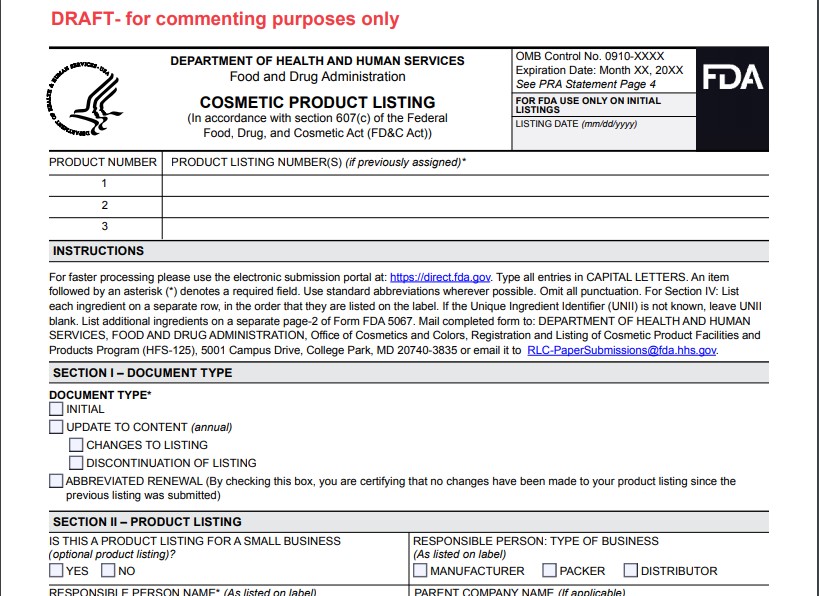
- 5067為產品清單登記表,以下為表格的部分信息:
背景補充
2022年發布的《化妝品監管現代化法案》(MoCRA)對1938年頒布的《聯邦食品、藥品和化妝品法案》進行重大修訂。MoCRA賦予FDA新的權力,擴大FDA對化妝品的監管范圍,包括設施注冊、產品清單登記以及小企業豁免。
2023年8月7日,FDA根據MoCRA的要求發布了《化妝品設施注冊及產品清單登記指南》草案,以上信息均屬于該草案,此外也對設施注冊及產品清單所需材料、電子提交平臺做了具體介紹,詳情見瑞旭解讀“美國《化妝品設施注冊及產品清單登記指南》草案已發布,輸美產品該如何合規?”。
- 設施注冊:生產或加工化妝品的企業必須向FDA注冊其設施,并且每兩年更新注冊。若FDA有合理理由確定企業在美國分銷的化妝品可能導致嚴重的不良健康后果或導致死亡,并且有合理理由認為該設施制造或加工的其他產品可能受到類似的影響,無法對一個或多個產品分割,或者后果的普遍性足以引發對該設施制造的其他產品的擔憂,FDA有權暫停設施注冊;如果設施注冊被暫停,該工廠的化妝品將禁止在美國分銷或銷售(或以其他方式引入或交付市場)。
- 產品清單登記:責任人必須向FDA登記每種上市的化妝品,包括產品成分,并且每年進行相關更新。上述的責任人是指名稱出現在化妝品標簽上的制造商、包裝商或分銷商。
- 小企業豁免:小企業是指過去3年在美國銷售化妝品的平均年度總銷售額低于100萬美元(根據通貨膨脹進行調整)的責任人、設施的所有者和經營者。MoCRA對某些小型企業免除了設施注冊和產品清單要求,但這些豁免不適用于從事以下制造或加工的企業:在習慣或通常使用條件下,可能經常接觸眼睛粘膜的化妝品;注射用化妝品;內用化妝品;在習慣或通常使用條件下,旨在改變外觀超過24小時化妝品(消費者對其的去除不屬習慣或通常的使用條件的一部分)。
