一、2021年化妝品新原料備案數據分析
自2020年6月29日《化妝品監督管理條例》(國令第727號)發布以來,一系列的配套法規相繼推出,其中與化妝品新原料注冊備案相關的新法規文件包括《化妝品注冊備案管理辦法》、《化妝品新原料注冊備案資料管理規定》及《化妝品安全評估技術導則》等。2021年5月1日起,化妝品新原料注冊備案需在國家藥品監督管理局網上辦事大廳的化妝品智慧申報審評系統中進行申請。
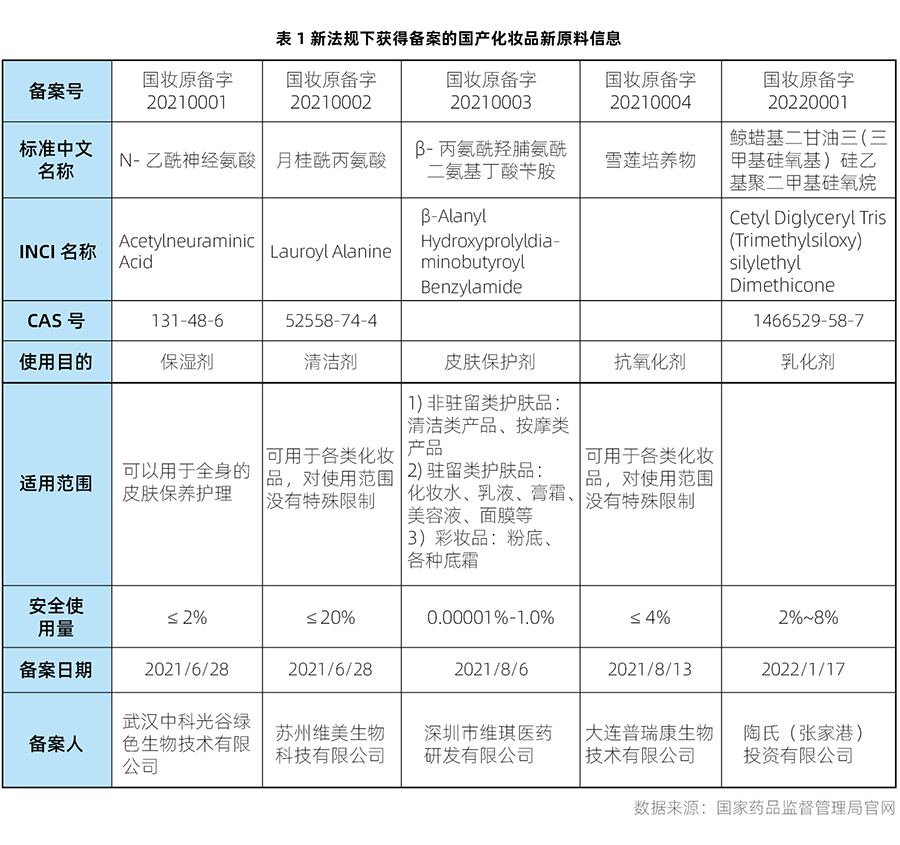
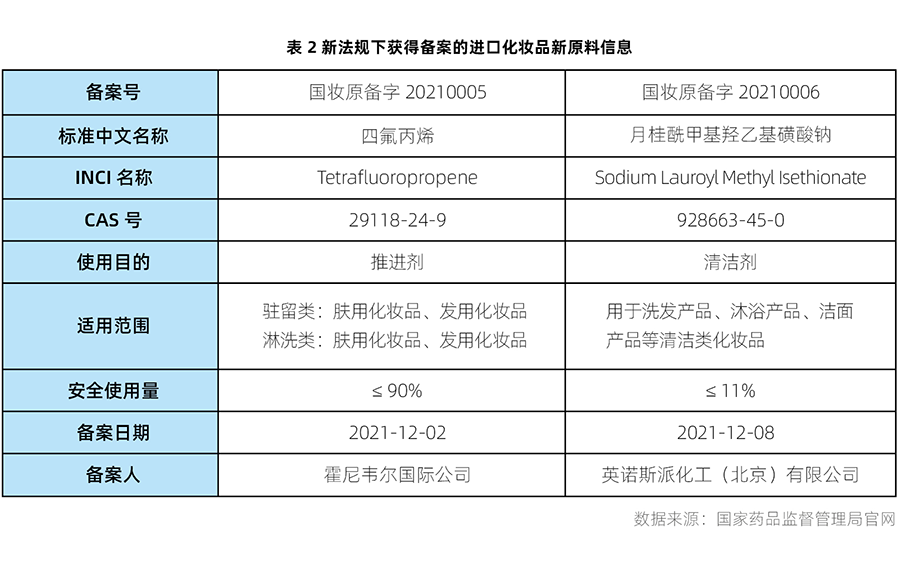
自新法規實施以來,2021年5月1日至2022年1月24日期間,共有7個化妝品新原料通過備案。其中5個屬于國產化妝品新原料(具體信息詳見表1),2個屬于進口化妝品新原料(具體信息詳見表2)。瑞旭集團日化團隊成功協助兩家原料企業完成首個進口新原料和第2個進口新原料的備案。
根據2021年4月23日中國食品藥品檢定研究院發布關于化妝品新原料過渡期處理細則的公告,對原化妝品行政許可系統已受理尚未作出行政許可決定的化妝品新原料有兩種處理方式:
1)申請人可于2021年5月1日前提出撤回行政許可申請,辦理申報資料退回手續;
2)申請人未按期提出撤回行政許可申請的,自2021年5月1日起,中檢院擬按照《化妝品新原料注冊備案資料管理規定》的資料要,求繼續完成審評審批工作。
上表中通過備案的3個化妝品新原料來自原化妝品行政許可系統已受理尚未作出行政許可決定的化妝品新原料(共計37件)。
根據《化妝品注冊備案管理辦法》第二章化妝品新原料注冊和備案管理第十二條:調整已使用的化妝品原料的使用目的、安全使用量等的,應當按照新原料注冊、備案要求申請注冊、進行備案。表明在使用已備案的化妝品新原料過程中,其使用目的、適用范圍以及安全使用量需參照公布的備案信息。如果信息有更新或調整需按照新原料注冊備案要求重新進行申請。
二、舊法規體系下化妝品新原料注冊數據分析
在舊法規《化妝品衛生監督管理條例》下,從2004年至2021年5月1日前,一共批準了14個新原料(具體信息詳見表3)。
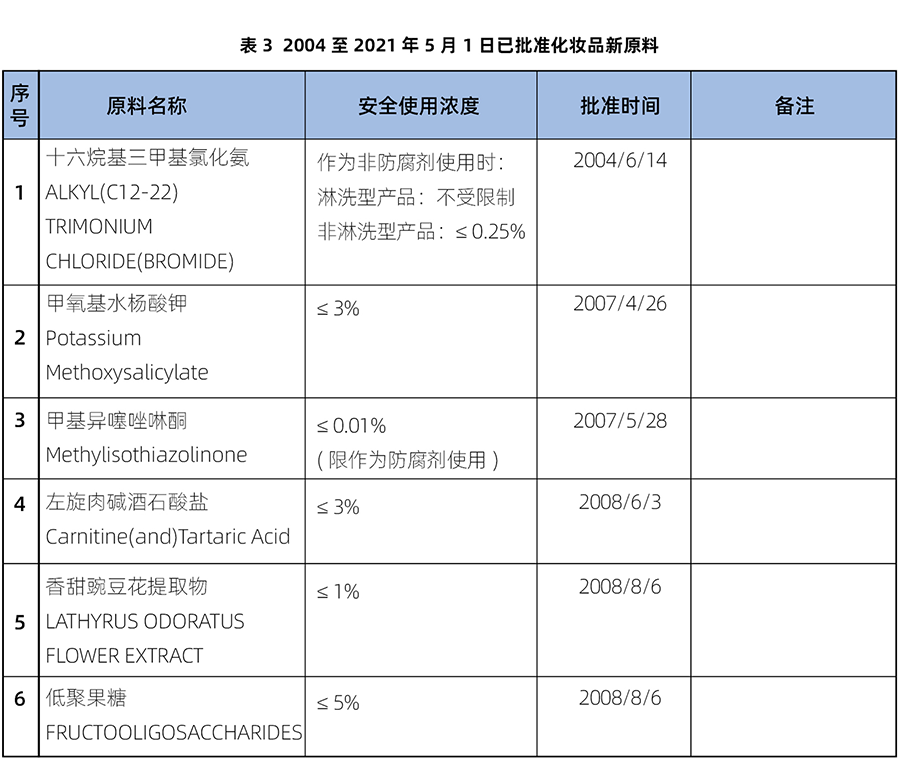
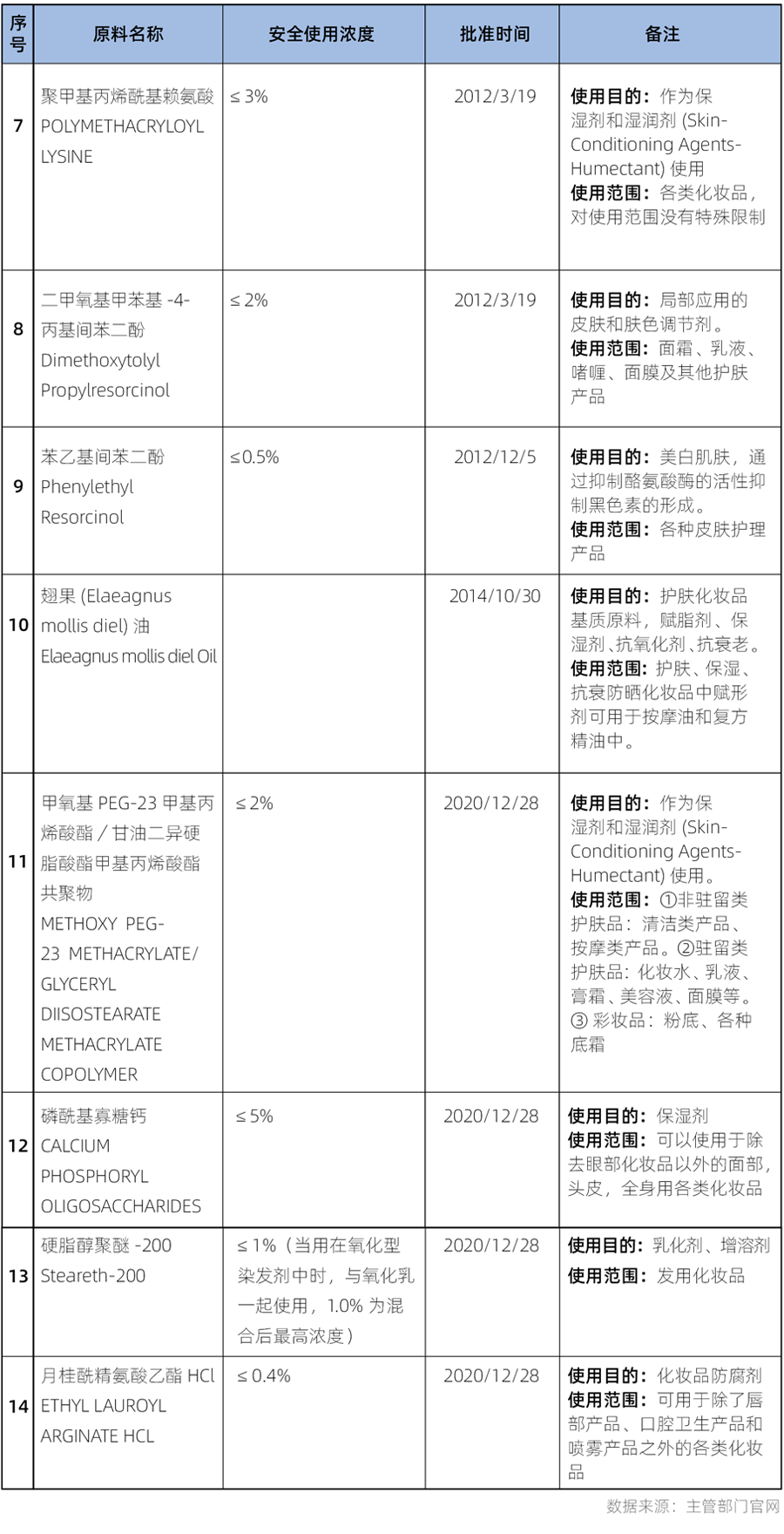
上表中1-6號原料由原衛生部批準,7-10號原料由原國家食品藥品監督管理(總)局批準,11-14號由國家藥品監督管理局批準。這些原料的審批過程也見證了有關國家機構的變遷和更迭。2008年9月化妝品的衛生行政許可工作由衛生部移交至國家食品藥品監督管理局。2013年3月22日,國家食品藥品監督管理局(State Food and Drug Administration,簡稱SFDA)改名為國家食品藥品監督管理總局(China Food and Drug Administration,簡稱CFDA。2018年4月10日,國務院機構改革中原“國家食品藥品監督管理總局”也正式變更為“國家藥品監督管理局”)。
三、中國化妝品新原料法規發展進程
● 1989年《化妝品衛生監督管理條例》
根據《化妝品衛生監督管理條例》第九條,使用化妝品新原料生產化妝品,必須經國務院衛生行政部門批準。化妝品新原料是指在國內首次使用于化妝品生產的天然或人工原料。
● 2011年《化妝品新原料申報與審評指南》
該文件于2011年7月1日實施。其中包括化妝品新原料定義、安全性要求、申報資料要求、審評原則。
● 2011年關于進一步規范化妝品新原料行政許可有關事項的通知
該通知對毒理學實驗開展前的數據要求以及毒理學實驗報告要求等內容進行了闡述。
● 2015年國家食品藥品監督管理總局關于發布已使用化妝品原料名稱目錄(2015版)的通告
依據《化妝品衛生監督條例》等有關規定,國家食品藥品監督管理總局對2014年6月30日發布的已使用化妝品原料名稱目錄進行了調整更新,形成了已使用化妝品原料名稱目錄(2015版)。目錄收錄了8783個化妝品原料。該目錄作為判斷是否屬于化妝品新原料的依據。
● 2020年《化妝品監督管理條例》
根據《化妝品監督管理條例》第四條,化妝品原料分為新原料和已使用的原料。國家對風險程度較高的化妝品新原料實行注冊管理,對其他化妝品新原料實行備案管理。根據《化妝品監督管理條例》第十一條,在我國境內首次使用于化妝品的天然或者人工原料為化妝品新原料。具有防腐、防曬、著色、染發、祛斑美白功能的化妝品新原料,經國務院藥品監督管理部門注冊后方可使用;其他化妝品新原料應當在使用前向國務院藥品監督管理部門備案。國務院藥品監督管理部門可以根據科學研究的發展,調整實行注冊管理的化妝品新原料的范圍,經國務院批準后實施。
● 2021年國家藥監局關于發布《已使用化妝品原料目錄(2021年版)》的公告
依據《化妝品監督管理條例》相關規定,國家藥監局組織對《已使用化妝品原料目錄名稱(2015版)》進行修訂,形成了《已使用化妝品原料目錄(2021年版)》,現予公布,自2021年5月1日起施行。目錄收錄8972個化妝品原料。
● 2021年《化妝品新原料注冊備案資料管理規定》
涵蓋化妝品新原料注冊備案資料要求內容。
● 2021年關于化妝品新原料過渡期處理細則的公告
針對原化妝品行政許可系統已受理尚未作出行政許可決定的化妝品新原料的處理方式。
● 2021年國家藥監局關于試行化妝品電子注冊證的公告
自2022年1月1日起,按照《化妝品注冊備案管理辦法》提出申請并獲準注冊的特殊化妝品和化妝品新原料,開始發放電子注冊證。
四、新舊監管體制比較
在過去舊監管體系下,化妝品新原料審批難、審批慢的原因主要表現在以下幾個方面:
1. 前期無統一的參考目錄判定是否屬于新原料;
2. 由于《化妝品衛生監督條例》未對新原料進行細化分類,新原料的申報要求較高,《化妝品新原料申報與審評指南》的資料要求沒有進行細化說明,造成技術審評過程中存在專家與企業對審評要求理解不一致、原料生產商為保護商業秘密不愿意提供足夠的信息等問題;
3. 化妝品原料管理體系較不完善,比如批準后的新原料如何監管;通常啟動一個化妝品新原料項目,瑞旭集團日化團隊都會建議企業做好五年以上的準備。批準的新原料通過公告形式對外公示,意味著所有企業可以直接生產和/或使用批準的新原料。這樣的管理方式難以鼓勵原料生產商開展新原料申請,不利于促進化妝品產業創新;
4. 動物實驗數據的強制要求與2013年歐盟全面禁止動物實驗的化妝品法規相違背,使得很多進口尤其歐洲化妝品新原料項目難以啟動或中途夭折;
5. 無對外交流窗口可以直接與審評專家溝通討論審評意見;
6. 美容產業技術創新的必要性不及藥品和食品產業。
在新監管體系下,化妝品新原料管理變化主要表現在:
1. 化妝品新原料根據風險程度進行分級管理,取代舊監管體系下的“一刀切”方式,對待高風險的化妝品新原料基本保留了原有管理模式。而對于非高風險的化妝品新原料采取備案制,大大縮短了官方審評時間。依據瑞旭集團日化團隊經驗,舊監管體系下的化妝品新原料項目周期約一半以上的時間徘徊在資料補充和技術審評環節;
2. 相較2011年7月1日實施的《化妝品新原料申報與審評指南》,今年5月1日實施的《化妝品新原料注冊備案資料管理規定》無疑更加完善和明晰了化妝品注冊備案資料要求。新監管體系下的化妝品注冊備案資料要求與舊監管體系相比沒有減少反而有所增加,比如增加了功效依據資料、安全使用歷史相關資料等;
3. 《化妝品新原料注冊備案資料管理規定》中明確了動物替代方法要求。意味著“動物替代方法”的大門終于向化妝品新原料打開,只是對于未收錄于《化妝品安全技術規范》的動物替代試驗方法需要確認其是否已被國際權威替代方法驗證機構收錄,且需要提交該方法能準確預測該毒理學終點的證明資料。雖然國內的動物替代方法在逐步完善,但目前已經接受的替代方法仍然有限,導致新法規實施前期對很多國際化妝品原料企業來說,動物實驗數據依然成為化妝品新原料項目推進的阻力之一;
4. 對于一些非高風險的功能性新原料如防脫發、祛痘、抗皺(物理性抗皺除外)、去屑、除臭功能,雖然按照備案制管理,但其毒理實驗要求同高風險新原料仍然保持一致;
5. 細化毒理實驗情形,比如只有針對國內外首次使用的有健康危害效應(不包括局部毒性)的新原料才要求開展毒物代謝及動力學試驗;對于國內外首次使用的高風險的新原料、較高生物活性的新原料、納米新原料,需要考慮長期人體試用安全試驗、皮膚吸收/透皮試驗、免疫毒性試驗;
6. 毒理安全評估要求參考最新的《化妝品安全評估技術導則(2021年版)》進行制作;
7. 對通過注冊備案的新原料設定3年監測期,即在監測期內,新原料注冊人或備案人擁有新原料的使用權,每年應定期向國務院藥品監督管理部門報告新原料使用和安全情況。
由于舊監管體系下對化妝品新原料沒有分類管理,加之審評尺度未結合化妝品原料的特點進行細化,在我國獲批的化妝品新原料屈指可數。雖然新監管體系下對化妝品新原料安全性和注冊備案資料方面并沒有放松要求,但化妝品新原料分級管理制度有利于風險性較小的化妝品新原料通過備案盡早上市,同時對新原料設定3年監測期,即在監測期內,新原料注冊人或備案人擁有新原料的使用權,每年應定期向國務院藥品監督管理部門報告新原料使用和安全情況。因此,3年安全風險監測期的設置讓申請企業的利益獲得保障的同時也讓企業主動承擔起安全風險監測的責任。這無疑大大促進了產業創新與發展。相信在科學監管體系下,化妝品新原料備案的春天已到來。
相關推薦:
- 2022年的首個化妝品新原料備案花落陶氏
- 國家藥監局關于14批次化妝品檢出禁用原料的通告(2022年第7號)
- 化妝品原料安全信息登記平臺上線通知
- 喜訊!瑞旭集團助力Innospec公司獲得進口化妝品新原料備案號!
- 中國化妝品原料法規數據庫(ChinaCosIng)升級版發布啦!
我們的服務:
