NDI是“New Dietary Ingredient”的縮寫,也稱之為“新膳食成分”,是指在1994年10月15日之前未投放美國市場的膳食成分。根據美國 FDA 的要求,銷售含有NDI的膳食補充劑的制造商和分銷商,必須在產品進入貿易前至少75天向FDA提交安全性資料進行備案,即NDI通知(NDIN)。NDI 通知及其相應的FDA答復函都可在FDA網站上公開查閱。提交的材料應盡可能使FDA作出“可保證產品足夠安全”的結論,如FDA后續發現所提交的材料不能再保證產品足夠安全時會對其采取相應執法行為。瑞旭集團CIRS對近4年來有關美國NDI通知的提交情況作了如下整理:
2021年以來NDI通知的提交情況
自2021年以來,美國FDA總共收到136份NDI通知(圖1),其中79份已通過FDA的認可,43份因某些原因未通過,還有12份因所通知的物質無法確定為膳食成分而不予回復(圖 2、圖3)。
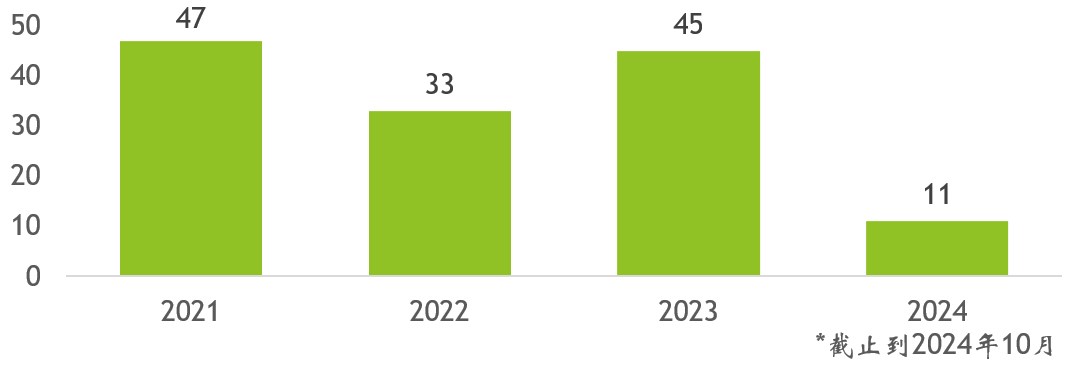
圖1. 2021年以來NDI通知的提交數量
2024年10月更新
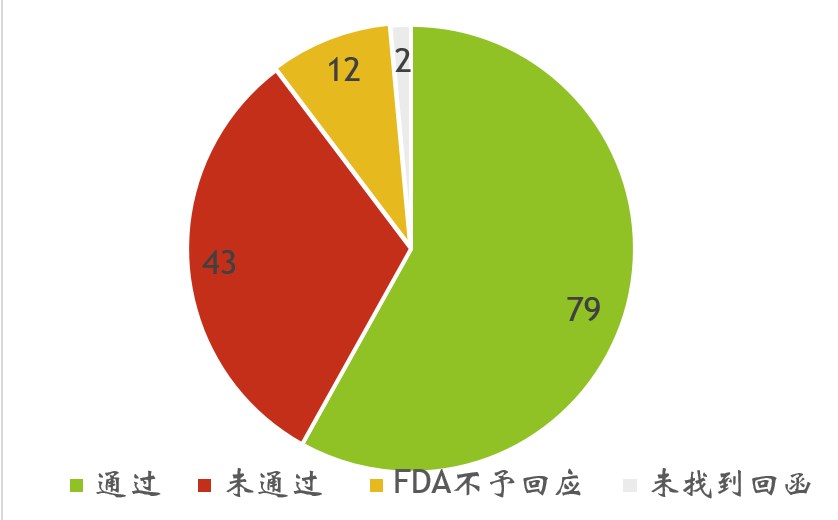
圖2. 2021年以來FDA對每份NDI通知的各類答復結果統計
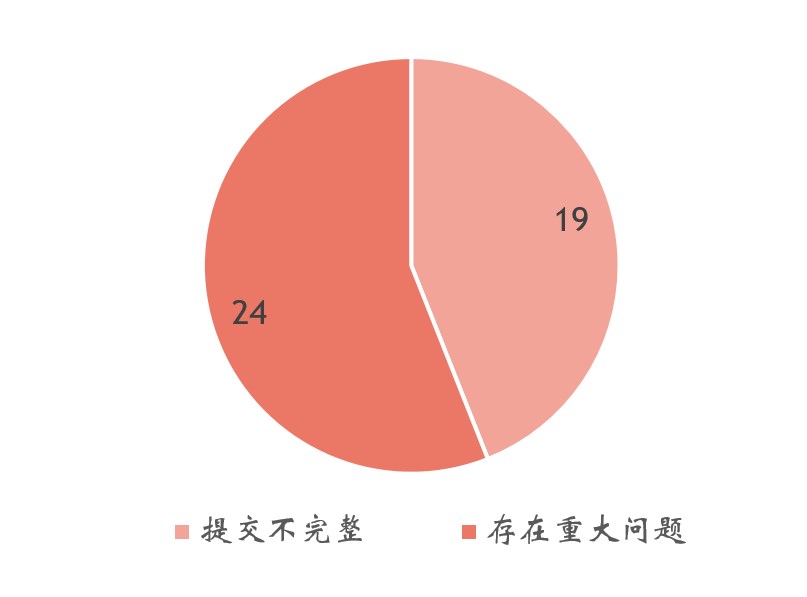
圖3. NDI通知未通過原因的統計
提交次數
在已通過的申請中,約有五分之一是之前未通過的同一或類似物質的再次提交(圖 4)。第二次提交后一般都會成功獲得認可,但NDI 1306 除外,該材料在第四次提交后才被FDA認可通過。
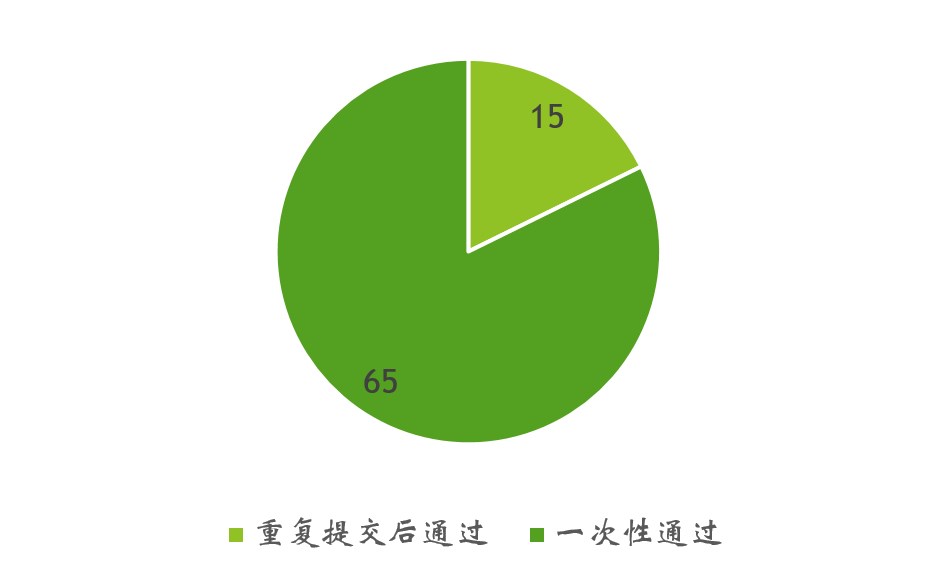
圖4. NDI 通知:一次性通過或重復提交后通過的數量對比
煙酰胺單核苷酸(NMN): 一個特例
在 FDA 未提供回應的 NDI通知中,有幾個與煙酰胺單核苷酸 (NMN) 有關,因為根據通知中提供的信息,它們無法被確認為膳食成分。此前,FDA 已于2022 年5月16日認可了尚科生物對NMN的NDI通知(NDI 1247)。然而FDA于2022年11月4日在一封補充回復信中撤銷了其原NDI的通知,信中指出,FDA 決定將NMN排除在膳食補充劑之外。
2023年3月6日,美國天然產品協會(NPA)提交了一份公民請愿書,要求FDA確認NMN未被排除在膳食補充劑定義之外。在隨后關于NMN的NDI通知中,FDA表示,他們對通知的回應將取決于他們對該請愿的決定。2023年8月30日,FDA對該公民請愿書做出答復,稱“由于機構事項繁多”,FDA無法在有限的時間內對該請愿做出決定。
2024年8月28日,NPA對FDA提起訴訟,要求其停止對NMN非法追溯適用《聯邦食品、藥品和化妝品法案》。最近,2024年10月24日,FDA請求美國哥倫比亞特區地方法院暫停與該訴訟有關的法律程序,以便FDA評估與NMN相關的請愿書。FDA 表示,在考慮請愿書的同時,不會優先考慮對合法銷售和分銷含有NMN的膳食補充劑產品采取相關執法行動,將于2025年7月31日前對NPA的請愿書做出最新裁決。
