2024年9月13日,國家食品安全風險評估中心(CFSA)發布《食品加工用遺傳修飾微生物安全性評價申報材料要求(試行)》(以下簡稱《申報材料要求(試行)》),預示著利用基因工程技術改造的微生物生產的新產品已面向三新食品(包括新食品原料、食品添加劑新品種、食品相關產品新品種)全面打開申報通道。
根據申報經驗,瑞旭集團CIRS帶您快速了解該類產品的最新申報要求。
1. 什么是食品加工用遺傳修飾微生物生產的產品?
相較于利用化學合成、提取等傳統工藝生產的產品,食品加工用遺傳修飾微生物生產的產品通常可以理解為:利用基因工程技術改變基因組構的微生物所生產的新食品原料、新食品添加劑、新食品相關產品。
2. 產品具體有哪些分類?
《申報材料要求(試行)》中提到,根據產品的組成、目標產物含量等檢測數據、產品中外源基因殘留檢測數據、產品中遺傳修飾微生物殘留檢測數據、環境風險控制措施及效果等數據及報告,對產品做出分類:Ⅰ類為純化產品,Ⅱ類為復合產品。而根據瑞旭集團以往的申報經驗,實際上利用遺傳修飾微生物生產的產品可以分為四大類:
分類 | I類 | II類 | III類 | IV類 |
產品屬性 | 純化產品 | 復合產品 | 死菌 | 活菌 |
化學特征 | 結構、純度、組成明確 | 不完全明確 | / | / |
產品是否含新引入基因片段 | 無 | 無 | 有 | 有 |
產品是否含遺傳修飾微生物 | 無 | 無 | 有,但不能增殖或轉移 | 有,能夠增殖或轉移 |
產品舉例 | 母乳低聚糖、氨基酸、維生素 | 大多數酶制劑 | 重組表達豆血紅蛋白的酵母 | 活發酵劑 |
3. 不同產品的申報路徑
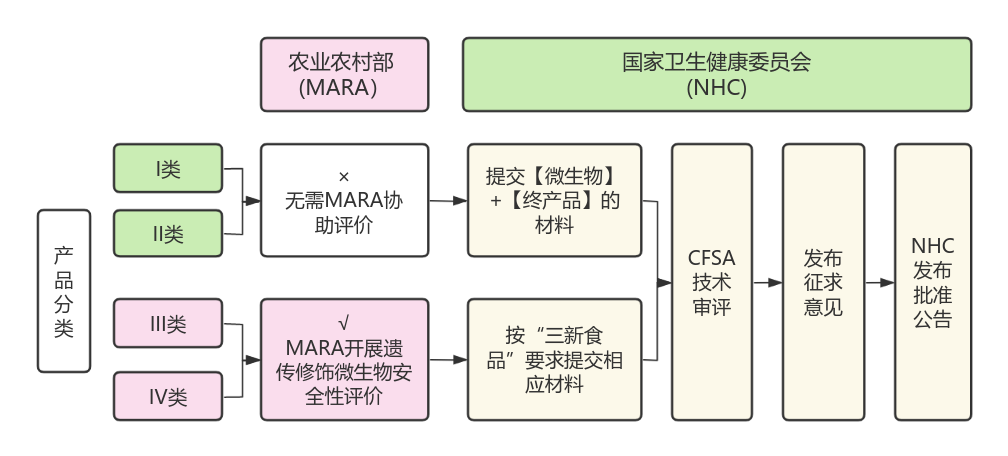
2021年我國對新食品添加劑開通遺傳修飾微生物申報通道時,這類產品需要經過兩個監管部門的評估:國家衛生健康委員會、農業農村部。
隨著本次《申報材料要求(試行)》的發布,根據企業的產品分類不同,所經歷的申報路徑將有所不同:I類和II類產品只需經過“國家衛生健康委員會”的審評審批。而據瑞旭了解,III類和IV類還是會分兩步走:需要先通過農業農村部的安全性評估,通過后再提交至國家衛生健康委員會進行審評審批。
具體如下:
4. I類、II類產品資料要求(微生物部分)
根據《申報材料要求(試行)》要求,涉及遺傳修飾微生物的I類、II類產品需要提交以下相關內容:
1.產品分類信息 | 1.1 產品的組成、目標產物含量等檢測數據 |
1.2 產品中外源基因殘留檢測數據 | |
1.3 產品中遺傳修飾微生物殘留檢測數據 | |
1.4 環境風險控制措施及效果 | |
1.5 產品分類說明 | |
2.遺傳修飾微生物相關信息 | 2.1 基本信息 |
2.2 分類學及鑒定資料 | |
2.3 生物學特性資料 | |
2.4 生長環境條件資料 | |
2.5 其他國家法規資料 | |
2.6 食品加工用遺傳修飾微生物的安全性評價 | |
3.受體微生物的安全性評價 | 3.1 背景資料 |
3.2 生物學特性 | |
3.3 適應的生態環境 | |
3.4 遺傳變異 | |
3.5 其他資料 | |
3.6 安全等級 | |
4.基因操作的安全性評價 | 4.1 食品加工用遺傳修飾微生物中引入或修飾性狀和特性的描述 |
4.2 實際插入或刪除序列的資料 | |
4.3 載體信息 | |
4.4 載體中插入區域各片段的資料 | |
4.5 基因操作方法 | |
4.6 遺傳穩定性 | |
4.7 目的基因的檢測和鑒定技術 | |
4.8 確定基因操作的安全類型 |
- 瑞旭CIRS提示:
① 除上述資料外,終產品還應按照“三新食品”申報與受理相關規定提供相關材料。
② Ⅲ類和 IV類產品的申報材料還應按照農業轉基因生物安全證書申報要求按階段提供相關資料。
5. “法規發展歷程”回顧
在我國,利用食品加工用遺傳修飾微生物生產的“三新食品”的申報是逐步開放的。
- 2017年,僅受理轉基因微生物酶制劑新品種申報。
- 2021年,又打開轉基因微生物食品添加劑的申報。
- 隨著合成生物學技術的持續發展和政策支持,2024年9月,國家監管部門正式全面開放利用食品加工用遺傳修飾微生物生產的“三新食品”申報通道。

關于瑞旭集團CIRS
瑞旭集團食品事業部具有專業的三新食品技術團隊,在三新食品(新食品原料、食品添加劑新品種、食品相關產品新物質)申報領域經驗豐富且具有眾多成功案例。目前,瑞旭集團已代理數十款利用食品加工用遺傳修飾微生物生產的新原料、添加劑項目申報,且有多項成功案例(包括母乳低聚糖、甜菊糖苷、酶制劑等),項目經驗位于行業前列。歡迎垂詢或拜訪進一步了解我們的技術實力!
聯系方式
- 電話:0571- 87206538(俞經理)
- 郵箱:food@jianzaoshiwang.cn
- 地址:杭州市濱江區秋溢路288號東冠高新科技園1號樓11層
瑞旭服務
