自2018年7月《保健食品檢驗與評價技術規范(2003年版)》廢止后,時隔五年,于 2023年8月31日,國家市場監督管理總局發布5項保健食品(非營養素補充劑類)的允許聲稱保健食品功能目錄及其配套文件,其中包含著無數保健食品企業翹首以盼的“保健食品功能評價方法”。5項文件包括:
- 《允許保健食品聲稱的保健功能目錄 非營養素補充劑(2023年版)》;
- 《保健食品功能檢驗與評價技術指導原則(2023年版)》;
- 《保健食品功能檢驗與評價方法(2023年版)》;
- 《保健食品人群試食試驗倫理審查工作指導原則(2023年版)》;
- 《〈允許保健食品聲稱的保健功能目錄 非營養素補充劑(2023年版)〉及配套文件解讀》
自今日起,保健食品新產品注冊工作終可以正式啟動。瑞旭集團將帶領您一起快速了解上述文件中的主要變化,并歸納總結保健食品注冊類產品的檢測要求。
PART 1 5項新文件的主要變化
變化1:保健功能由27種變為24種,功能聲稱用語被修訂
與此前發布的征求意見稿一致,功能性保健食品允許聲稱的保健功能正式由原來的27種變為24種,促進泌乳、改善生長發育、改善皮膚油份3個與保健功能定位不符的舊功能被正式取消。同時,對保留的24種保健功能聲稱用語均進行了修訂,整體功能用語更加科學規范(對比詳見表1)。
變化2:功能評價要求總體未變,但方法細節有更新
經瑞旭集團對比,新的功能評價方法在對24個保健功能需要開展的動物實驗和(或)人體試食試驗的要求上并未發生變化。例如:“有助于增強免疫力”仍然只需要開展動物試驗,“有助于抗氧化”仍需要開動物實驗+人體試食試驗。但新方法在一些細節均進行了一定更新,例如某些檢測項目增多,評價指標變化等。
值得注意的是,新的功能評價方法由原來的強制性方法改為了推薦性方法。從法規角度來說,這些方法不再強制執行,任何個人、企業、科研機構和社會團體在科學研究論證的基礎上可以提出新的功能評價方法。但新方法的采用并不容易,需要參照《保健食品原料目錄與保健功能目錄管理辦法》的納入程序,經評估認可后,方可供注冊使用。因此,無特殊情況下,仍建議企業采用官方發布的推薦性方法。
變化3:明確老批件的過渡要求
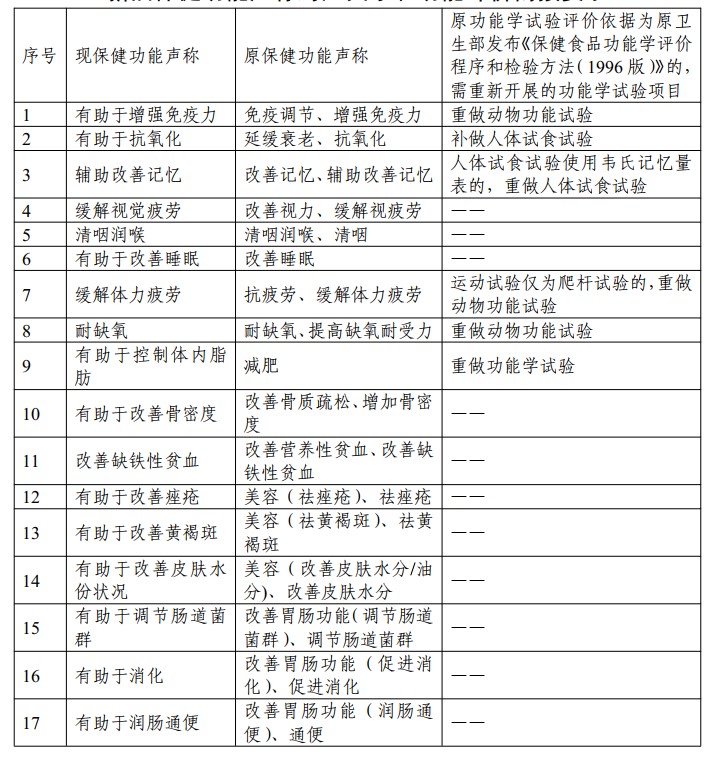
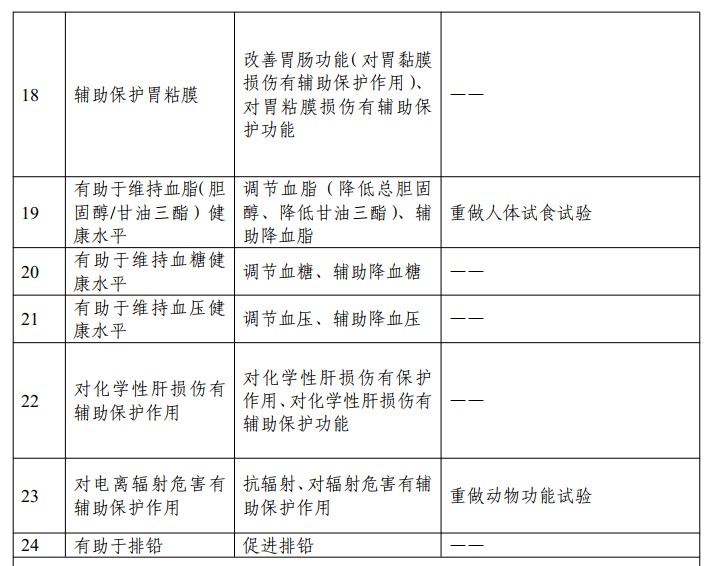
- 保健功能已列入《功能目錄》的產品: 設定 5 年過渡期,規范產品的保健功能聲稱。功能學評價依據為96年版方法的老批件,需重做/補做功能試驗(詳見表2)。
- 保健功能未列入《功能目錄》的產品: 5年內,申請變更功能或進行“新功能”的納入申報;
- 注冊證書“無有效期和無產品技術要求”的: 視情況,根據現行法規提出產品換發證書申請;
表1:新舊功能實驗要求對比
|
S.N. |
舊保健功能 |
新保健功能(2023版) |
功能試驗總要求 (無變化) |
|
1 |
增強免疫力 |
有助于增強免疫力 |
動物功能試驗 |
|
2 |
抗氧化 |
有助于抗氧化 |
動物功能試驗、人體試食試驗 |
|
3 |
輔助改善記憶 |
輔助改善記憶 |
動物功能試驗、人體試食試驗 |
|
4 |
緩解視疲勞 |
緩解視覺疲勞 |
人體試食試驗 |
|
5 |
清咽 |
清咽潤喉 |
動物功能試驗、人體試食試驗 |
|
6 |
改善睡眠 |
有助于改善睡眠 |
動物功能試驗 |
|
7 |
緩解體力疲勞 |
緩解體力疲勞 |
動物功能試驗 |
|
8 |
提高缺氧耐受力 |
耐缺氧 |
動物功能試驗 |
|
9 |
減肥 |
有助于控制體內脂肪 |
動物功能試驗、人體試食試驗 |
|
10 |
增加骨密度 |
有助于改善骨密度 |
動物功能試驗 |
|
11 |
改善營養性貧血 |
改善缺鐵性貧血 |
動物功能試驗、人體試食試驗 |
|
12 |
祛痤瘡 |
有助于改善痤瘡 |
人體試食試驗 |
|
13 |
祛黃褐斑 |
有助于改善黃褐斑 |
人體試食試驗 |
|
14 |
改善皮膚水份 |
有助于改善皮膚水份狀況 |
人體試食試驗 |
|
15 |
調節腸道菌群 |
有助于調節腸道菌群 |
動物功能試驗、人體試食試驗 |
|
16 |
促進消化 |
有助于消化 |
動物功能試驗、人體試食試驗 |
|
17 |
通便 |
有助于潤腸通便 |
動物功能試驗、人體試食試驗 |
|
18 |
對胃粘膜損傷有輔助保護功能 |
輔助保護胃粘膜 |
動物功能試驗、人體試食試驗 |
|
19 |
輔助降血脂 |
有助于維持血脂(膽固醇/甘油三酯)健康水平 |
動物功能試驗、人體試食試驗 |
|
20 |
輔助降血糖 |
有助于維持血糖健康水平 |
動物功能試驗、人體試食試驗 |
|
21 |
輔助降血壓 |
有助于維持血壓健康水平 |
動物功能試驗、人體試食試驗 |
|
22 |
對化學性肝損傷有輔助保護功能 |
對化學性肝損傷有輔助保護作用 |
動物功能試驗 |
|
23 |
對輻射危害有輔助保護功能 |
對電離輻射危害有輔助保護作用 |
動物功能試驗 |
|
24 |
促進排鉛 |
有助于排鉛 |
動物功能試驗、人體試食試驗 |
|
25 |
促進泌乳 |
取消 |
/ |
|
26 |
改善生長發育 |
取消 |
/ |
|
27 |
改善皮膚油份 |
取消 |
/ |
表2:《新舊保健功能聲稱對應關系和功能評價銜接要求》

PART2 保健食品注冊時需要開展哪些試驗?
2018年7月,《保健食品檢驗與評價技術規范(2003版)》被廢止后,無檢測依據,新品注冊工作無法推進。為了解決這一問題,市場監管總局組織啟動了對《保健食品檢驗與評價技術規范》的全面修訂工作。截止目前,保健食品的毒理學評價方法、衛生學理化檢驗規范、菌種安全性評價、功能評價方法等文件均已正式發布,保健食品注冊檢驗工作得以重新正式開展。
根據要求,目前,在我國申請保健食品注冊時,需提交以下試驗報告:
|
S.N. |
試驗項目 |
基本要求 |
|
1 |
3批次自檢報告 |
應包括產品技術要求全部技術指標。 |
|
2 |
3批次功效成分或標志性成分、衛生學、穩定性試驗 |
普通樣品通常開展加速試驗,該類樣品保質期一般為2年,樣品應置于37±2℃、RH75±5%、避免光線直射的條件下貯存3個月,于0、1、2、3月取樣檢測。其中,0月數據可以使用同批次樣品衛生學試驗結果。 |
|
3 |
功效成分或標志性成分檢驗方法的方法學驗證 |
I. 引用國家相關標準方法的,也應考察該方法的檢出限、精密度、準確度、線性范圍; II. 目前暫不將益生菌類標志性成分檢測方法學研究資料作為強制性要求。 |
|
4 |
毒理試驗 |
I. 一般包括:急性經口毒性試驗、三項遺傳毒性試驗、28天經口毒性試驗; II. 應與功能試驗在一家實驗室進行,使用同一批次樣品,且為3批次穩定性檢測的樣品批次之一。 |
|
5 |
動物功能試驗和(或)人體試食試驗 |
應與毒理試驗在一家實驗室進行,使用同一批次樣品,且為3批次穩定性檢測的樣品批次之一。 |
|
6 |
若有必要,開展其他試驗(視乎具體產品而定,如菌種鑒定、菌株毒力試驗報告等) |
/ |
官方公告: 市場監管總局 國家衛生健康委 國家中醫藥局關于發布《允許保健食品聲稱的保健功能目錄 非營養素補充劑( 2023 年版)》及配套文件的公告
瑞旭服務
相關推薦:
- 瑞旭FAQ:跨境電商平臺銷售的保健食品需要注冊或備案嗎?—2023年第八期
- 瑞旭FAQ:保健食品申報時配方可以保密嗎? —2023年第七期
- 瑞旭網絡研討會QA整理:保健食品備案注冊申報經驗分享和難點分析
- 免費使用!食品、保健食品原輔料一站式查詢平臺:食規查正式上線啦!
聯系方式
杭州瑞旭科技集團有限公司
- 電話:0571- 87206538(俞經理)
- 郵箱: food@jianzaoshiwang.cn
- 地址:杭州市濱江區秋溢路288號東冠高新科技園1號樓11層
